ALCÈNES ou OLÉFINES
Préparation et modes de formation
Méthodes de réduction
L' hydrogénation ménagée des alcynes conduit aux alcènes :
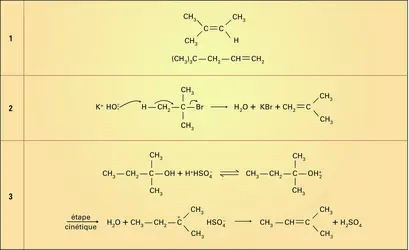
– le sodium ou le lithium dans l'ammoniac liquide réduit l'hexyne-2 en hexène-2, essentiellement trans, par un processus radicalaire :
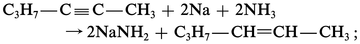
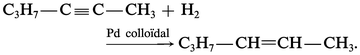
Méthodes d'élimination
Ce sont les plus simples et les plus générales.
Déshydrohalogénation
Les bases fortes telles que la potasse alcoolique réagissent, à température modérée, sur les halogénures d'alkyle selon un mécanisme bimoléculaire en éliminant une molécule d'acide halogéné (réaction 2).
Déshydratation
Les alcools tertiaires sont facilement déshydratés par un chauffage modéré en présence d'un catalyseur acide fort. Le mécanisme de cette élimination est normalement unimoléculaire E1 : le catalyseur acide transforme le mauvais groupe partant HO- en bon groupe partant H2O et permet ainsi l'élimination unimoléculaire de ce groupe (cf. mécanismes réactionnels). Le carbocation formé est rapidement déprotoné par les bases présentes dans le milieu (réaction 3).
Les alcools secondaires et primaires ne sont déshydratés que par chauffage vers 150-170 0C avec l'acide sulfurique concentré, et le mécanisme procède également par protonation de la fonction alcool, mais l'élimination du proton en α est bimoléculaire ; c'est le mécanisme E2 (réactions 4). Le milieu acide nécessité par ces réactions favorise le réarrangement de l'oléfine formée, et on obtient souvent des mélanges.
Enfin, en phase gazeuse, entre 180 et 450 0C selon la classe de l'alcool, l'alumine catalyse sa déshydratation en alcène.
Désamination
Le groupement amine tertiaire est un bon groupe partant, et le chauffage de l'hydroxyde d'ammonium quaternaire conduit au départ d'eau et de l'amine tertiaire par le mécanisme E2 (réaction 5).
Éliminations intramoléculaires
Le chauffage à température élevée d'un acétate d'alkyle conduit à l'élimination d'une molécule d'acide acétique, et l'oléfine obtenue ne s'isomérise pas (réaction 6) ; une réaction semblable peut être réalisée sur un méthylxanthogénate d'alkyle (réaction 7).
Toutes ces méthodes d'élimination sont rarement sélectives, indépendamment des réarrangements déjà signalés des oléfines formées sous l'action des milieux acides : la régiosélectivité de ces éliminations dépend à la fois de facteurs électroniques, mais principalement de facteurs stériques liés à la taille des groupes en α du proton éliminé, à la taille du groupe partant et à celle de la base employée. En général, deux orientations sont possibles : l'une, dite de Saytzeff, conduit à l'oléfine la plus substituée ; l'autre, dite de Hofmann, à la moins substituée. Une augmentation de la taille des éléments signalés plus haut induit un pourcentage plus élevé de l'oléfine la moins substituée :
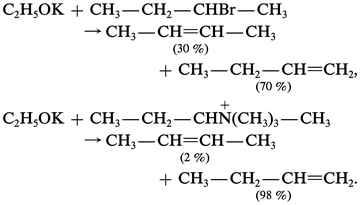
Méthodes de dégradation
Les acides α, β et γ-éthyléniques se décarboxylent très facilement et plus régulièrement que les acides saturés :
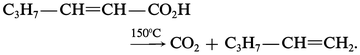
Méthodes synthétiques
L' action d'un organomagnésien mixte sur le bromure d'allyle permet la formation d'une α-oléfine, sans isomérisation :
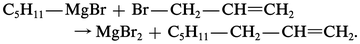
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ALCÈNES ou OLÉFINES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
L'hydrolyse des esters sulfuriques d'alkyle, obtenus par addition de l'acide sur un alcène, est une réaction de ce type. -
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
Ces dérivés sont facilement obtenus par addition d'un halogène Cl2 ou Br2 à un alcène. Sous l'action de la potasse alcoolique, à température modérée, une première déshydrohalogénation a lieu, conduisant à un halogénure vinylique. La seconde est beaucoup plus difficile et nécessite des conditions... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Addition sur les alcènes : l'aminomercuration de ces dérivés résulte de l'action d'une amine primaire ou secondaire et d'acétate mercurique. Le composé acétomercurique obtenu peut être réduit par NaBH4 et on obtient le produit d'addition de l'amine sur l'alcène (réaction). -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Deux procédés industriels mettent en œuvre l'addition, sur des oléfines, de CO + H2O : - Afficher les 14 références
Voir aussi
- POLYMÉRISATION
- POLYADDITION
- POLYÉTHYLÈNE
- PROPYLÈNE
- ÉTHYLÈNE
- ÉPOXYDATION
- PHOSPHINE (phosphure d'hydrogène)
- ORBITALES MOLÉCULAIRES
- HYDRATATION
- HYDROGÉNATION
- MARKOVNIKOV RÈGLE DE
- ISOMÉRISATION
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- ALIPHATIQUES ou ACYCLIQUES COMPOSÉS
- ADDITION, chimie
- ALKYLATION ou ALCOYLATION
- DÉSAMINATION
- DÉSHYDROHALOGÉNATION
- DÉSHYDROGÉNATION
- ALDÉHYDES
- KHARASH EFFET
- OXACIDES ou OXOACIDES
- ÉLIMINATION, chimie
- DÉSHYDRATATION
- HALOGÉNATION
- ÉLECTRONIQUE STRUCTURE
- ZIEGLER-NATTA PROCÉDÉ
- MÉTATHÈSE, chimie
- NOMENCLATURE, chimie
- STÉRÉO-ISOMÉRIE
- RÉACTIVITÉ CHIMIQUE
- POLYOLÉFINES
- HYDROHALOGÉNATION
- HYDROBORATION
- OZONATION
- HYDROFORMYLATION ou RÉACTION OXO