OXYGÈNE
L'ozone
État naturel et préparation
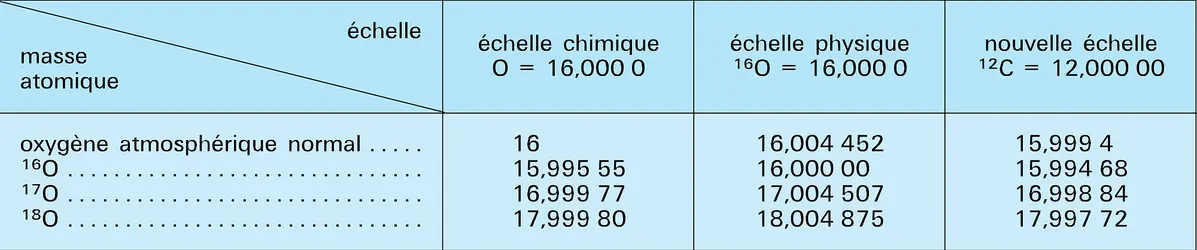
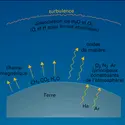
Le trioxygène, plus stable des variétés allotropiques du dioxygène, fut appelé ozone en 1839 par Christian Friedrich Schönbein, en raison de son odeur caractéristique (du grec ozein, « exhaler une odeur »). Ce n'est qu'en 1865 que Jacques-Louis Soret démontra l'existence d'une molécule O3 de masse 47,998 g par la prédominance de l'isotope 16 (cf. chap. 1) . Sa concentration dans l'atmosphère est extrêmement faible (2 × 10—8), mais sa présence revêt une importance primordiale. En effet, une couche située à environ 25 kilomètres d'altitude absorbe la quasi-totalité de la partie ultraviolette du spectre solaire qui éliminerait toute trace de vie, tout au moins sous sa forme actuelle. Le mode de formation le plus probable semble être par décharge électrique dans le dioxygène sec :
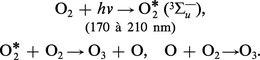
L'ozone se forme également dans de nombreuses réactions : décomposition de H2O2, dans l'arc électrique, par électrolyse, etc., mais la préparation industrielle ne repose plus que sur la décharge par effluve à haute tension (50 à 80 kV) dans l'air ou le dioxygène.
Structure et propriétés physiques
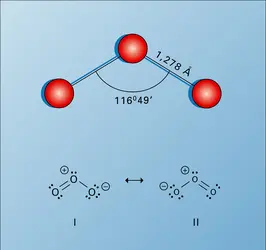
La structure spatiale de l'ozone est maintenant bien connue (fig. 3) ; c'est une molécule angulaire. En revanche, la nature des liaisons est encore discutée. En effet, la distance O—O est plus courte que celle d'une simple liaison (0,143 nm) mais supérieure à celle de la molécule O2 (0,121 nm). L'ozone présentera donc plusieurs structures de résonance dont les deux plus fréquentes sont indiquées à la figure 3.
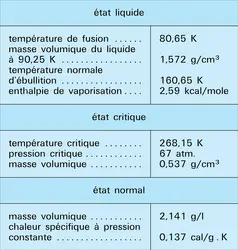
Les principales caractéristiques physiques de l'ozone sont données par le tableau 7. Sous forte épaisseur, l'ozone présente une coloration bleue qui tend vers l'indigo à l'état liquide. Notons que le rapport Cp/Cv est égal à 1,29 au lieu de 1,33 pour les gaz triatomiques.
La solubilité de l'ozone dans l'eau est nettement supérieure à celle du dioxygène : 0,52 l/l au lieu de 0,049 (à 0 0C) ; il est aussi très soluble dans les fréons 12 et 13.
Propriétés chimiques
La réaction de formation étant endothermique : 3 O2 ⇌ 2 O3, ΔH0 = 284,58 kJ, l'ozone ne serait stable qu'à haute température. Il convient donc de le maintenir dans un état métastable à la température ambiante, car il peut se décomposer parfois brutalement suivant le schéma : O3 → O2 + O, ΔH0 = 102,53 kJ. Ce mécanisme peut être accéléré par la présence d'un tiers corps :
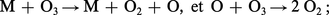

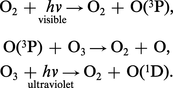
Le rendement quantique atteint 6,7 en ultraviolet.
De nombreuses réactions en phase gazeuse ont été étudiées, surtout du point de vue de la cinétique : celle du NO qui se transforme en NO2, lui-même oxydé en N2O5, de l'ammoniac qui donne NH4NO3, et celles des halogènes. L'ozone attaque tous les métaux sauf l'or et le platine ; l'argent, pratiquement inaltéré par le dioxygène, se recouvre d'une couche d'oxyde.
Dans de nombreux cas, c'est l'ozone lui-même qui joue le rôle d'un catalyseur d'oxydation vis-à-vis du dioxygène qui l'accompagne. C'est le cas par exemple des réactions avec le sulfite de sodium et de certaines réactions organiques : oxydation des aldéhydes, des cétones, quinones, alcools et esters.
En solution aqueuse, les potentiels d'oxydoréduction du dioxygène et de l'ozone sont, respectivement, en solution acide :
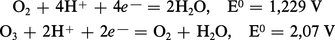
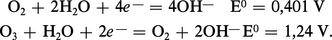
L'ozone est donc un agent oxydant des plus actifs, dépassé seulement par le difluor et l'oxygène atomique. Tous les sels métalliques sont oxydés à leur degré supérieur. L'eau oxygénée[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert CREUSE : chef du service information et gestion, direction des centres de recherche et de développement de la société Air liquide
- René NOTO : médecin-colonel, anesthésiste-réanimateur, chargé de l'enseignement de la médecine d'urgence et de la médecine de catastrophe au service de santé des armées
Classification
Pour citer cet article
Robert CREUSE et René NOTO. OXYGÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
AÉROBIOSE & ANAÉROBIOSE
- Écrit par Claude LIORET
- 2 734 mots
- 1 média
-
AÉRONOMIE
- Écrit par Gaston KOCKARTS
- 4 157 mots
- 11 médias
...reproductibles. De nouveaux constituants atmosphériques apparaissent et sont susceptibles d'influencer à leur tour la structure de l'atmosphère. En partant de l' oxygène moléculaire (O2), dont la première limite de dissociation est à 242,4 nm, le rayonnement solaire produit des atomes d'oxygène suivant le mécanisme... -
AIR
- Écrit par Jean PERROTEY
- 2 154 mots
- 2 médias
...vie. Le constituant actif est assimilé au gaz obtenu par calcination du salpêtre, ou « nitre », d'où le nom d'« esprit nitro-aérien » alors donné à l' oxygène. Un siècle plus tard, la nature de l'air est vraiment élucidée par Lavoisier. L'expérience par laquelle il établit la composition de l'air est,... -
ANÉMIES
- Écrit par Bruno VARET
- 3 091 mots
- 5 médias
...d'hémoglobine. Les constituants des globules rouges autres que l'hémoglobine semblent n'avoir pour fonction que de protéger l'hémoglobine de l'oxydation. La fonction essentielle de l'hémoglobine est le transport de l'oxygène. Il est donc logique que la baisse de la pression partielle en oxygène au niveau... - Afficher les 69 références
Voir aussi
- OZONE
- PEROXYDES
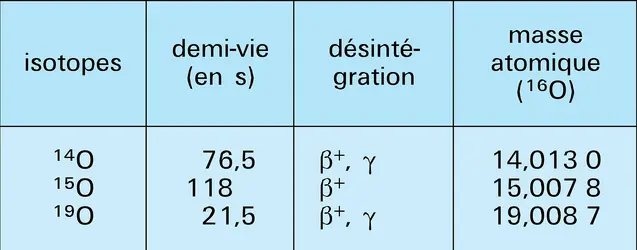
- ISOTOPES
- PARAMAGNÉTISME
- ÉPURATION DES EAUX
- RÉANIMATION
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- CAISSON HYPERBARE
- DÉPOLLUTION
- GAZODUC
- RESPIRATION ARTIFICIELLE ou VENTILATION ARTIFICIELLE
- CHIMIQUES INDUSTRIES
- OXYACÉTYLÉNIQUE CHALUMEAU
- DÉSINFECTANTS
- COVALENTE LIAISON
- MASSE ATOMIQUE
- EAU OXYGÉNÉE (peroxyde d'hydrogène)
- OZONIDES
- SUPEROXYDES
- ORBITALES MOLÉCULAIRES
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- DEGRÉ D'OXYDATION
- OXYDATION
- OXYDANTS
- OXYGÈNE ATMOSPHÉRIQUE
- GAZEUX ÉTAT
- SINGULET ÉTAT
- ÉLECTRONIQUE STRUCTURE
- OXHYDRIQUE CHALUMEAU
- INSUFFISANCE RESPIRATOIRE
- CONFIGURATION ÉLECTRONIQUE
- SOINS INTENSIFS
- OXYGÉNOTHÉRAPIE
- RESPIRATOIRE PATHOLOGIE
- RESPIRATION
- RESPIRATION ASSISTÉE ou ASSISTANCE RESPIRATOIRE
- DÉTRESSE RESPIRATOIRE AIGUË
- OXYDES
- FLUORURES
- IONIQUE LIAISON
- VENTILATION PULMONAIRE
- URGENCES, médecine
- OXYGÈNE LIQUIDE