NITRILES
On désigne sous le nom de nitriles les composés organiques dont la formule renferme le groupe fonctionnel C≡N relié à un groupe hydrocarboné quelconque.
Les nitriles n'existent guère à l'état naturel, en dehors de certains glucosides tels que l'amygdamine de l'huile d'amande amère, qui est une cyanhydrine du benzaldéhyde combinée à un disaccharide, le gentiobiose : C6H5−CH(OC12H21O10)−C≡N.
La plupart sont des intermédiaires de synthèse. L'un d'entre eux, le nitrile acrylique CH2=CH−C≡N, est le monomère de macromolécules constituant des fibres textiles (Orlon, Crylor). En copolymérisation avec le butadiène, il fournit des élastomères « azotés » doués de propriétés remarquables, telles que la résistance aux huiles et aux agents chimiques, et, avec le butadiène et le styrène, il forme des résines solides de hautes performances (résines ABS). L'hydrolyse de l'acrylonitrile conduit en outre à l'acide acrylique dont les esters sont les monomères de la synthèse des résines acryliques.
Officiellement, les nitriles portent le nom de l'hydrocarbure dont ils dérivent par fixation sur un carbone de la chaîne d'un atome d'azote triplement lié, suivi du mot « nitrile ». Par exemple, CH3−CH2−C≡N est le propane nitrile. Mais d'autres nomenclatures courantes les désignent comme nitrile de l'acide correspondant : c'est ainsi que l'éthane nitrile CH3−C≡N est le plus souvent appelé acétonitrile, ou nitrile acétique, et le phényl-2 éthane nitrile C6H5−CH2−C≡N phénylacétonitrile, ou cyanure de benzyle.
Préparations
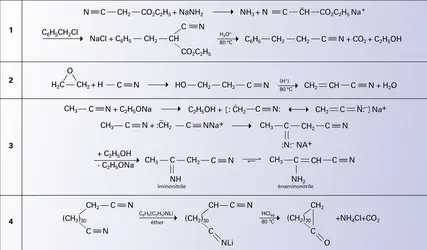
Les nitriles se forment en principe par déshydratation des amides. Cette réaction se produit par chauffage sous l'action de déshydratants énergiques tels que le pentoxyde ou le pentachlorure de phosphore (P4O10, P2Cl10). Les amides résultant de l'ammonolyse des esters, on fait passer un mélange des vapeurs d'un ester carboxylique et d'ammoniac sur un catalyseur d'alumine à 350 0C ; l'amide intermédiaire est déshydraté :

Les nitriles se préparent également par déshydratation des aldoximes ou par thermolyse des phénylhydrazones d'aldéhydes en présence de chlorure cuivrique :

Les méthodes les plus intéressantes sont de nature synthétique. La plus importante, due à Kolbe, met en œuvre le cyanure de potassium en solution hydro-alcoolique et un halogénure ou un sulfonate d'alkyle ; la réaction, procédant par un mécanisme SN2, est pratiquement limitée aux dérivés primaires ; à côté du nitrile, il se forme de petites quantités d'isonitrile ou carbylamine :

Cet isomère est obtenu majoritairement avec le cyanure d'argent ; dans ce cas, le mécanisme se rapproche du processus SN1 et le carbocation (électrophile dur) est attaqué par le site nucléophile azoté (nucléophile dur) de l'anion ambident cyanure :
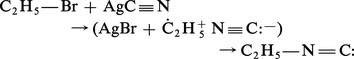
La réaction des sulfonates aromatiques avec le cyanure de sodium est plus difficile et exige une température plus élevée. Une méthode générale de formation des nitriles aromatiques fait appel à la décomposition d'un sel d'aryldiazonium par le cyanure cuivreux ( réaction de Sandmeyer, 1884) :
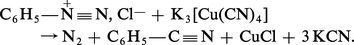
Les nitriles peuvent également être obtenus par la synthèse cyanacétique : un dérivé halogéné réagit avec le sel de sodium du cyanacétate d'éthyle en donnant un homologue alkylé ou arylé de cet ester. Une hydrolyse prudente libère le nitrile β-acide, dont la décarboxylation, par simple chauffage, conduit au nitrile de formule R−CH2−C≡N (réaction).
Les nitriles α-éthyléniques résultent de la déshydratation facile des nitriles β-alcools provenant de l'addition de l'acide cyanhydrique sur un époxyde. L' acrylonitrile peut ainsi être obtenu à partir de l'oxyde d'éthylène (réaction). La synthèse industrielle de cet important monomère est réalisée par ammonoxydation[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. NITRILES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
L' hydratation des nitriles, en catalyse acide ou basique, conduit aux amides primaires, mais la réaction est difficile à contrôler car ces derniers, dans ces conditions, s'hydrolysent en sel d'ammonium de l'acide. On peut toutefois contrôler cette hydratation en employant l'eau oxygénée qui forme un... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Ces dernières sont également obtenues par l'hydrogénation catalytique des nitriles sur catalyseur de nickel à 100 0C. On les prépare enfin par réduction des imines : ces dernières résultant de l'action de l'ammoniac sur un dérivé carbonylé, ces deux composés sont soumis à l'hydrogénation :... -
CASSINI-HUYGENS (MISSION)
- Écrit par Athéna COUSTENIS
- 4 179 mots
- 8 médias
...chimiquement et produisent des composés organiques complexes (essentiellement des hydrocarbures comme l’éthane, l’acétylène et le propane, ou des nitriles comme l’acide cyanhydrique) qui se diffusent à travers l’atmosphère, se condensent et viennent se déposer à la surface de ce satellite. Les mesures... -
CYANURE D'HYDROGÈNE
- Écrit par Universalis
- 331 mots
Également appelé formonitrile, le cyanure d'hydrogène H—C≡N est un liquide incolore, très mobile, de forte odeur d'amandes amères, fortement toxique et miscible à l'eau en toutes proportions : ses solutions sont connues sous le nom d'acide cyanhydrique ou acide prussique (nom provenant du...
- Afficher les 8 références
Voir aussi