AMIDES
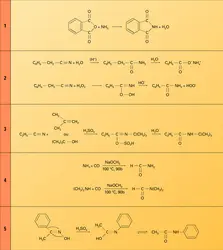
Les amides d'acides carboxyliques, ou carboxamides, sont les dérivés de la fonction acide dont le groupe hydroxyle est remplacé par un groupe aminé −NH2, amides primaires, −NHR, secondaires, ou −NRR′, tertiaires. Ils peuvent également être considérés comme les dérivés acylés de l'ammoniac et des amines primaires ou secondaires, plusieurs groupes acyle pouvant être portés par la fonction azotée : monoamides R−CO−NH2, diamides (R−CO)2NH, triamides (R−CO)3N.
Les monoamides primaires et les diamides cycliques sont les plus importants. Les amides primaires et secondaires se présentent comme des mélanges équilibrés d'isomères (protomères) dans lesquels l'hydrogène est porté soit par l'azote, soit par l'oxygène fonctionnel :
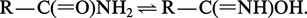
Cet équilibre, analogue à l'équilibre céto-énolique, joue un rôle important dans la réactivité des amides.
Les monoamides simples n'apparaissent que très rarement à l'état naturel. La fonction amide, accompagnée d'autres fonctions, intervient dans certains alcaloïdes mais surtout dans la structure des protéines des êtres vivants, dont l'importance est fondamentale. La fonction amide secondaire est également présente dans les polyamides de synthèse qui constituent des matières plastiques de grande importance (nylons).
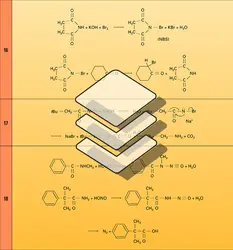
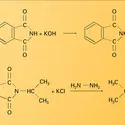
Les amides des acides sulfoniques, ou sulfonamides (sulfamides), ont été les premiers antibiotiques de synthèse et, depuis 1935, ont révolutionné la lutte contre les maladies infectieuses.
Nomenclature
Comme celui des acides carboxyliques dont ils dérivent, le nom des amides est formé de celui de la chaîne hydrocarbonée suivi du suffixe amide : alcanamides. Le nom des monoamides secondaires et tertiaires découle de celui de l'amide primaire de même chaîne, précédé du nom des groupes alkyle ou aryle portés par l'atome d'azote. Une nomenclature courante issue de celle des acides remplace le suffixe -ique de leur nom par amides. Les diamides provenant de diacides aliphatiques sont dénommés imides. Les monoamides cycliques sont appelés lactames et leur forme tautomère, lactimes.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Formation d'un amide. Le nucléophile est l'ammoniac ou encore une amine primaire ou secondaire. On chauffe le sel d'ammonium ou d'aminium qui se déshydrate en amide. En fait, le sel est en équilibre avec l'acide et l'ammoniac, et c'est la réaction entre ces deux partenaires qui conduit, par une... -
NITRILES
- Écrit par Jacques METZGER
- 1 793 mots
- 1 média
Voir aussi