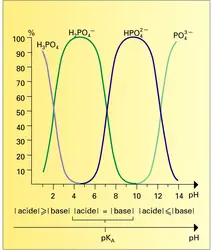
SOLUTION ÉQUILIBRES EN
Réactions de formation de complexes (transfert d'ions ou de molécules polaires)
Définitions
Complexes. Couple donneur-accepteur d'une particule
Un complexe est une entité formée de l'association de deux ou plusieurs espèces chimiques, ions ou molécules polaires. Les complexes métalliques, qui réunissent un cation métallique et une ou plusieurs espèces « complexantes » avec échange de liaisons de coordination, sont les plus importants en pratique (cf. complexes [chimie]).
Par exemple, l'ion FeSCN2+ est un complexe formé entre les ions Fe3+ et SCN-, Cu(NH3)42+ est un complexe formé entre l'ion Cu2+ et quatre molécules d'ammoniac (molécule polaire), FeY- un complexe formé entre le cation Fe3+ et l'ion Y4-, Y4- symbolisant l'anion éthylènediaminetétracétate (E.D.T.A.), réactif chélatant des cations métalliques d'usage courant.
Chaque complexe peut donc être défini comme un donneur de particule, celle-ci pouvant être un ion ou une molécule polaire. L'autre espèce joue alors le rôle d'accepteur conjugué dans le couple :
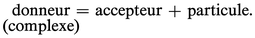
Par exemple, le complexe FeSCN2+ peut être considéré comme un donneur de thiocyanate (SCN- est la particule, Fe3+ est l'accepteur) ou comme un donneur de Fe3+ (Fe3+ est la particule, SCN- est l'accepteur). De même, d'après la définition précédente, Cu(NH3)42+ apparaît comme un polydonneur de la particule NH3.
Les acides, qui sont des donneurs de la particule H+ dans le modèle de Brönsted introduit précédemment, peuvent être considérés comme des complexes. L'étude des réactions de formation de complexes concerne l'ensemble des particules autres que H+ et l'électron. L'introduction des couples donneur-accepteur d'une particule quelconque correspond à une généralisation des concepts d'acido-basicité. Celle-ci apparaît clairement dans la définition des acides et des bases proposée par Lewis, selon laquelle un acide, électrophile, est porteur d'une lacune électronique (orbitales vacantes facilement accessibles du point de vue énergétique), et une base, nucléophile, est un donneur de doublet électronique. L'établissement d'une liaison entre ces deux entités, appelée réaction acide-base dans ce nouveau modèle, correspond de fait à ce que nous appelons ici la formation d'un complexe.
Réactions d'échange d'ions ou de molécules polaires
En règle générale, les particules n'existent pas à l'état libre en solution (elles n'y existent qu'à l'état solvaté), de telle sorte que pour qu'un donneur (donn1) cède une particule p, il faut qu'il se trouve en présence d'un accepteur (acc2) de la même particule. Entre les deux couples :
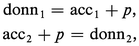

Celle-ci montre que, là encore, on ne peut envisager que des réactions de transfert entre le donneur d'un système et l'accepteur d'un autre système. La nécessité pour les deux couples de mettre en jeu la même particule permet de lever l'ambiguïté précédente quant au choix de son identité. Ainsi, la réaction entre FeSCN2+ et F- se traite en termes d'échange de la particule Fe3+ :


De nouveau, à l'écriture de ces réactions de transfert, apparaît l'intérêt d'établir un classement des donneurs (ou des accepteurs) d'une même particule, pour permettre de prévoir simplement le sens prédominant de telles réactions.
Prévision des réactions
Pouvoir accepteur du solvant. Constante de stabilité
La dissolution dans un solvant résulte de la solvatation des espèces par celui-ci. Le solvant peut donc jouer le rôle d'accepteur de toute particule :
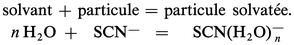
D'où l'idée d'établir le classement des donneurs d'une même particule d'après l'intensité de leur réaction sur le solvant qui joue le rôle[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude COLIN : docteur-ès-sciences maître-assistant de première classe
- Alain JARDY : docteur-ès-sciences maître-assistant de première classe à l'Ecole Supérieure de Physique et de Chimie Industrielles de Paris
Classification
Pour citer cet article
Claude COLIN et Alain JARDY. SOLUTION ÉQUILIBRES EN [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
...théorie de la dissociation ionique. Appliquée aux acides et bases, elle permit de préciser les notions précédentes et de les rendre quantitatives. Un acide HA est une substance qui, en solution aqueuse, fournit, lors de son équilibre de dissociation, des protons H+ :une base BOH est une substance...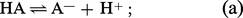
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ÉLECTROCHIMIE
- Écrit par Jacques SIMONET
- 6 252 mots
- 10 médias
...des accepteurs (ou inversement) peut être prévue par la connaissance de grandeurs thermodynamiques (telles que ΔG, variation de l'enthalpie libre) des réactions équilibrées élémentaires vis-à-vis de l'électron :Cette réaction constitue un exemple de transfert d'électron homogène ensolution.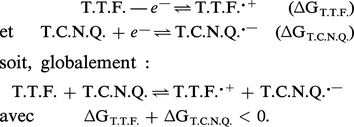
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 604 mots
- 4 médias
...déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie àl'équilibre classique d'un acide en solution dans l'eau (réaction 4).
Voir aussi
- DISSOCIATION IONIQUE
- IONS
- HYDROLYSE
- INDICATEURS COLORÉS
- pK
- RÉACTIONNELS MÉCANISMES
- AMPHOTÈRE CORPS
- AMPHOLYTE
- CHLORURE D'ARGENT
- EAU, physico-chimie
- FORCE D'UN ACIDE ou D'UNE BASE
- OXYDORÉDUCTION
- ÉQUILIBRE, chimie
- POTENTIEL D'OXYDORÉDUCTION
- ÉLECTRODES
- NERNST ÉQUATION DE
- SOLUBILITÉ
- SOLVATATION
- SURSATURATION, physico-chimie
- TITRAGE
- PRÉCIPITATION, chimie
- THERMODYNAMIQUE CHIMIQUE
- ÉLECTRODE AU CALOMEL
- OXYDANTS
- RÉDUCTEUR, chimie
- POTENTIEL CHIMIQUE
- CONCENTRATION, chimie
- DISMUTATION, chimie
- pH
- ACTION DE MASSE LOI D' ou LOI DE GULDBERG & WAAGE
- DISSOLUTION, chimie
- SOLUTION, chimie
- EDTA (acide éthylène-diamine-tétracétique)
- CONSTANTE D'ÉQUILIBRE, chimie
- ACIDITÉ ÉCHELLE D'
- ÉLECTROCHIMIE & ÉLECTROLYSE
- REDOX COUPLE
- TRANSFERT D'ÉLECTRONS