SOLUTION ÉQUILIBRES EN
Réactions d'oxydoréduction (transfert d'électrons)
Définitions
Les réactions d'oxydoréduction sont des réactions d'échange d'électrons faisant intervenir des accepteurs et des donneurs de cette particule : les oxydants peuvent fixer des électrons, les réducteurs peuvent en céder. La relation qui définit un oxydant, un réducteur, ou plus globalement un couple oxydoréducteur (en abrégé couple redox) est :
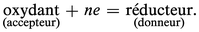
Par exemple,

Le passage des métaux en solution constitue un phénomène d'oxydoréduction :

De même, le dépôt d'un métal à partir d'une solution de l'un de ses ions correspond à une réduction :

Les ions H+ et l'oxygène dissous, qui interviennent dans les phénomènes de corrosion, sont des oxydants :

Un composé peut être à la fois oxydant dans un couple et réducteur dans un autre. On l'appelle alors ampholyte ; par exemple, le chlore Cl2 est oxydant dans le couple Cl2/Cl- et réducteur dans le couple HClO/Cl2 :

Réactions d'oxydoréduction
L'échange d'électrons peut s'effectuer de deux manières, soit en solution, soit à la surface d' électrodes, conducteurs électroniques.
Les électrons ne pouvant exister à l'état libre en solution, en particulier aqueuse, pour qu'un oxydant Ox1 d'un couple redox puisse fixer des électrons il faut qu'il soit en présence d'un réducteur Red2 appartenant à un autre couple et capable de les lui céder. Entre les deux couples :


Par exemple, les ions ferreux en présence de dichromate Cr2O72-, dans lequel le chrome est au degré d'oxydation (D.O.) VI+, cèdent leurs électrons (la considération des degrés d'oxydation permet de déterminer le nombre d'électrons échangés dans un système redox complexe). Les ions Fe2+ sont oxydés en Fe3+, le dichromate est réduit en Cr3+ :

C'est ainsi qu'on « équilibre » une réaction d'oxydoréduction : les électrons ne doivent plus figurer ; les deux membres de la réaction doivent comporter le même nombre d'atomes de chaque type et la même charge globale.
L'éthanal (aldéhyde acétique) est oxydable en éthanoïque (acide acétique) par le permanganate :

Prévision des réactions
Soit l'équilibre d'oxydoréduction (2) : il est important, en pratique, de savoir s'il est déplacé dans le sens 1 (oxydation de Red2 par Ox1 ; Ox1 étant alors dit plus fort que Ox2 ou Red2 plus fort que Red1) ou dans le sens 2 (oxydation de Red1 par Ox2).
Cette prévision peut se faire à l'aide du potentiel d'oxydoréduction de la solution.
Potentiel d'oxydoréduction d'une solution
Système simple. Potentiel normal
Considérons une solution contenant l'oxydant et le réducteur du système :

Le potentiel d'équilibre de cette solution est donné par la relation de Nernst :
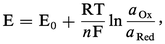
aOx et aRed sont les activités de l'oxydant et du réducteur. Comme il est d'usage en chimie des solutions, nous utiliserons les conventions et approximations suivantes :
– l' activité des solutés, présents en solution diluée (< 1 mol . l-1), est assimilée à leur concentration (notée | | ) ; en fait, ai = γiCi, avec γi coefficient d'activité tendant vers 1 quand C → 0 ;
– l'activité du solvant, de même que celle des solides (métaux, précipités), est par convention[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude COLIN : docteur-ès-sciences maître-assistant de première classe
- Alain JARDY : docteur-ès-sciences maître-assistant de première classe à l'Ecole Supérieure de Physique et de Chimie Industrielles de Paris
Classification
Pour citer cet article
Claude COLIN et Alain JARDY. SOLUTION ÉQUILIBRES EN [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
...théorie de la dissociation ionique. Appliquée aux acides et bases, elle permit de préciser les notions précédentes et de les rendre quantitatives. Un acide HA est une substance qui, en solution aqueuse, fournit, lors de son équilibre de dissociation, des protons H+ :une base BOH est une substance...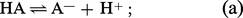
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ÉLECTROCHIMIE
- Écrit par Jacques SIMONET
- 6 252 mots
- 10 médias
...des accepteurs (ou inversement) peut être prévue par la connaissance de grandeurs thermodynamiques (telles que ΔG, variation de l'enthalpie libre) des réactions équilibrées élémentaires vis-à-vis de l'électron :Cette réaction constitue un exemple de transfert d'électron homogène ensolution.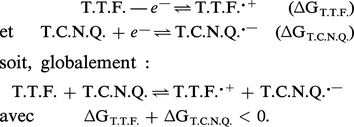
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 604 mots
- 4 médias
...déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie àl'équilibre classique d'un acide en solution dans l'eau (réaction 4).








