SOLUTION ÉQUILIBRES EN
- Article mis en ligne le
- Modifié le
- Écrit par Claude COLIN et Alain JARDY
Équilibres variés
Il est assez rare que les types de réactions évoqués précédemment (acido-basicité, oxydoréduction, formation de complexes, précipitation) se produisent seuls. Il a déjà été fait allusion à l'influence de l'acidité sur les propriétés oxydoréductrices et sur la solubilité. D'autres associations de deux de ces phénomènes présentent un grand intérêt.
Oxydoréduction et complexes. Oxydoréduction et précipitation
On peut modifier les propriétés oxydoréductrices par formation de complexes. Considérons le couple :


En milieu fluorure, Fe3+ est complexé selon :


Si, à une solution de Fe3+ et de Fe2+ on ajoute F-, |Fe3+| diminue et E également. Les ions ferriques sont devenus moins oxydants en présence de fluorure, ou encore les ions ferreux sont devenus plus réducteurs. Tout se passe comme si E0 avait diminué. En milieu fluorure le couple redox s'écrit :

Si on applique la loi de Nernst :


E1 est le potentiel normal apparent en milieu fluorure.
Dans le cas plus général où l'oxydant et le réducteur sont complexés, on démontre :

De même, la précipitation d'un oxydant ou de son réducteur conjugué modifie les propriétés du couple ; ainsi, en milieu chlorure, le couple Ag+/Ag devient AgCl(s) + e = Ag(s) + Cl- avec KS = |Ag+||Cl-|. Le potentiel normal E0 doit être remplacé par le potentiel normal apparent :

Cette modification des propriétés redox est très importante en pratique. Ainsi, l'or est très difficile à oxyder. Le couple Au3+/Au(s) a un potentiel normal E0 = 1,50 V et Au+ est instable (il se dismute en Au3+ et Au(s)). En milieu cyanure, Au(I) existe sous forme de complexe cyanure et est stabilisé. L'oxydation de l'or en Au(I) devient possible par l'oxygène (couple Au(CN)2-/Au(s), E′0 = 0,06 V). Cette réaction est mise en œuvre industriellement pour le traitement des minerais d'or.
Complexes et acidité
On peut modifier la stabilité d'un complexe en jouant sur le pH, ou inversement, modifier la force d'un acide ou d'une base par formation de complexes. Considérons l'équilibre (7) et l'équilibre H+ + F- = HF, qui montre que F- est une base. En milieu acide les ions fluorure sont consommés pour former HF et l'équilibre (7) se déplace vers la gauche : le complexe FeF2+ est détruit. On peut écrire l'équilibre global :

Il montre inversement que, en présence de Fe3+, l'acide fluorhydrique voit son acidité renforcée. Cette propriété peut être mise à profit pour renforcer l'acidité d'acides trop faibles pour être titrés avec précision en solution aqueuse. On peut citer, par exemple, le titrage de l'acide borique en présence de mannitol.
Solubilité et formation de complexes
On peut détruire un complexe par précipitation ou, inversement, redissoudre un précipité par formation de complexes.
Les ions argent Ag+ peuvent former, en présence d'ammoniac, le complexe argentodiammine Ag(NH3)2+ selon :


Ils peuvent également précipiter en présence de chlorure :


L'équilibre global s'écrit :


Cette valeur indique une tendance pour l'équilibre (8) à se déplacer vers la droite, c'est-à-dire que l'addition de chlorure dans une solution d'ions argentodiammine provoque la destruction de ce dernier avec précipitation de chlorure d'argent. Mais inversement, on peut redissoudre AgCl dans un excès d'ammoniaque. Le calcul montre qu'il est possible de dissoudre 10-2 mole de chlorure d'argent solide dans un litre d'ammoniaque à 0,22 mole . l-1.
Il arrive que la redissolution d'un précipité puisse s'effectuer dans un excès du réactif précipitant. C'est ainsi que le cyanure d'argent peut se redissoudre à la faveur de la formation de complexes supérieurs :[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude COLIN : docteur-ès-sciences maître-assistant de première classe
- Alain JARDY : docteur-ès-sciences maître-assistant de première classe à l'Ecole Supérieure de Physique et de Chimie Industrielles de Paris
Classification
Pour citer cet article
Claude COLIN et Alain JARDY. SOLUTION ÉQUILIBRES EN [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
...théorie de la dissociation ionique. Appliquée aux acides et bases, elle permit de préciser les notions précédentes et de les rendre quantitatives. Un acide HA est une substance qui, en solution aqueuse, fournit, lors de son équilibre de dissociation, des protons H+ :une base BOH est une substance...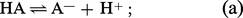
-
ACTIVITÉ, chimie
- Écrit par Dina SURDIN
- 260 mots
Grandeur introduite par G. N. Lewis, en 1907, pour exprimer les propriétés thermodynamiques des solutions. En effet, l'expression du potentiel chimique d'un composé dans une solution idéale, donné par la relation μ = kT ln N + μ0, où N représente la fraction molaire du composé,...
-
ÉLECTROCHIMIE
- Écrit par Jacques SIMONET
- 6 252 mots
- 10 médias
...des accepteurs (ou inversement) peut être prévue par la connaissance de grandeurs thermodynamiques (telles que ΔG, variation de l'enthalpie libre) des réactions équilibrées élémentaires vis-à-vis de l'électron :Cette réaction constitue un exemple de transfert d'électron homogène ensolution.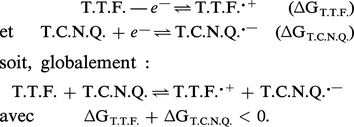
-
NITRIQUE ACIDE
- Écrit par Jean ROUXEL
- 1 604 mots
- 4 médias
...déjà 3,5 p. 100 des molécules HNO3. La dilution de l'acide pur dans de l'eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s'identifie àl'équilibre classique d'un acide en solution dans l'eau (réaction 4).








