DIPOLAIRES MOMENTS
Moment dipolaire et structure moléculaire
Représentation par moments de liaison
La démarche habituelle en physico-chimie, qui consiste à tenter la représentation d'une grandeur moléculaire quelconque comme somme d'incréments de liaison, aboutit dans le cas du moment dipolaire à introduire des moments de liaison de caractère vectoriel. Leur direction est celle de la liaison et leur sens est donné par la différence d'électronégativité entre les atomes liés, ce qui conduit ainsi à la notation C−Cl. La connaissance de ces moments de liaison résulte de l'analyse du moment moléculaire total, seul accessible, ce qui ne va pas sans quelque arbitraire. Il n'y a pas de difficulté pour les carbures saturés, non polaires, ce qui s'interprète aisément comme une conséquence de la disposition tétraédrique des liaisons, et cela quelle que soit la valeur du moment de la liaison C − H, qui n'est pas directement accessible. La présence d'un faible moment chez certains carbures – 0,13 D pour l'isobutane HC(CH3)3 par exemple – s'explique par la déformation de la molécule consécutive à l'encombrement stérique des groupements méthyles.
Ce moment de la liaison C−H s'introduit comme une constante inconnue dans la plupart des autres déterminations. C'est ainsi que la substitution d'un atome d'hydrogène par un atome de chlore donne à tous les chlorures d'alcoyle pratiquement le même moment de 2,10 D, qui représente μ (C−Cl) − μ (C−H), ces deux moments étant supposés arbitrairement de même sens.
L'extension de cette méthode de proche en proche conduit à dresser des tables de moments de liaison qui permettent le calcul approché du moment d'une molécule de géométrie connue. Les écarts à la loi d'addition vectorielle des moments de liaison s'interprètent en général aisément.
C'est ainsi que les moments des composés CH3Cl et CHCl3 sont respectivement 1,87 D et 1,01 D, alors que le calcul à partir des moments de C−H et de C−Cl devrait conduire à la même valeur. Lors du passage du chlorure de méthyle au chloroforme, le moment μ (C−H) croît certainement, alors que μ (C−Cl) diminue, ce qui va bien dans le sens observé ; en outre, il faut probablement tenir compte des moments induits portés par les atomes de chlore, fortement polarisables, la contribution relative des deux effets étant malaisée à évaluer.
Un exemple des hypothèses arbitraires introduites dans le calcul des moments de liaison est donné par la détermination de μ (C−O), à partir du moment de l'éther méthylique . La composition des moments permet d'écrire :
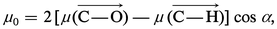
Malgré ces difficultés, la valeur du moment dipolaire d'une molécule constitue un élément d'information important dans l'étude de sa structure. La valeur nulle du moment du dioxyde de carbone n'est, par exemple, conciliable qu'avec la structure linéaire symétrique OCO. Inversement, la valeur du moment de l'eau oxygénée H2O2 (2,10 D) exclut[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean BARRIOL : Correspondant de l'Institut. Professeur émérite à l'Université Nancy
Classification
Pour citer cet article
Jean BARRIOL. DIPOLAIRES MOMENTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 26/06/2024
Médias
Autres références
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 236 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire etmoment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 447 mots
- 6 médias
Deux charges opposées localisées en des points distincts constituent un dipôle électrique. Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. - Afficher les 9 références






