DIPOLAIRES MOMENTS
Principes de la théorie des diélectriques
Cas des gaz
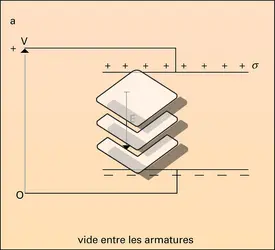
Le problème est simple dans le cas des gaz, les molécules étant suffisamment distantes, en moyenne, pour que leurs interactions puissent être négligées. S'il s'était agi d'une substance non polaire, la seule cause de polarité serait le moment induit, qui est en première approximation proportionnel au champ appliqué E, soit μ = μi = αE. Le coefficient α représente la polarisabilité moyenne, ou susceptibilité électrique moyenne, de la molécule. Le qualificatif « moyenne » rappelle le caractère tensoriel et non scalaire de la relation entre les vecteurs μi et E. Pour une substance non polaire, la relation (1) s'écrit alors :
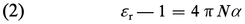
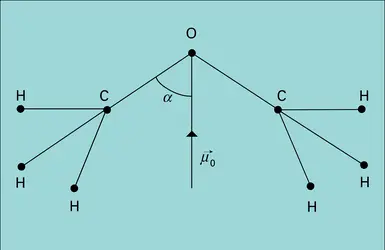
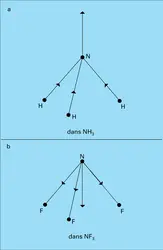
Lorsque la substance est polaire, il faut ajouter la contribution des dipôles permanents. En l'absence de champ électrique extérieur, l'agitation brownienne assure l'orientation au hasard des dipôles, d'où une valeur nulle de leur résultante. Le champ exercé E tend à conférer une orientation commune à ces dipôles, mais cette action, contrariée par l'agitation thermique, demeure extrêmement faible ; l'état de saturation, où tous les dipôles seraient parallèles au champ, est absolument inaccessible par suite des effets d'ionisation et de claquage dus aux champs électriques élevés, contrairement au comportement d'une substance paramagnétique dans un champ magnétique.
Le calcul statistique montre que dans le cas des champs électriques relativement faibles, auquel on est ainsi pratiquement limité, l'effet obtenu par cette orientation des dipôles est équivalent à un accroissement de la polarisabilité, de valeur αμ = μ02/3kT, qu'on désigne sous le nom de polarisabilité d'orientation (k est la constante de Boltzmann). L'énergie cinétique moyenne par degré de liberté, kT, exprime le rôle de l'agitation thermique à la température thermodynamique T, qui tend à s'opposer à l'action d'orientation du champ. Pour les molécules polaires, la relation (2) est alors remplacée par :
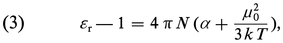
Une première méthode de mesure consiste à déterminer εr à deux températures différentes au moins, en s'appuyant sur le fait que α, qui est une grandeur moléculaire, demeure inchangée. Bien que la mesure de la permittivité d'un gaz soit délicate, ce procédé est utilisé et donne des résultats précis lorsque la substance dont on veut mesurer le moment est suffisamment volatile.
Une seconde méthode permet de connaître μ0 à partir de la mesure de εr à une température donnée, en utilisant la propriété des champs de fréquence suffisamment élevée de ne plus orienter les dipôles électriques, par suite de l'inertie moléculaire. Les fréquences minimales pour qu'il en soit ainsi, et qui marquent la limite du domaine de la relaxation diélectrique, appartiennent, pour la plupart des molécules, au domaine des ondes millimétriques. Pour ces champs de haute fréquence, la relation (3) s'écrit, si on laisse de côté la polarisation d'orientation :
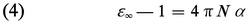
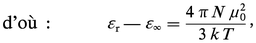
De telles mesures sont délicates ; en général, on se contente d'effectuer la mesure dans le domaine plus éloigné des radiations lumineuses, où elle se ramène à une mesure d'indice de réfraction n grâce à la relation de Fresnel ε = n2. Le choix usuel ε∞ ≃ n2 permet ainsi de déterminer α à partir de la mesure de l'indice de réfraction pour une radiation visible, généralement la raie D du sodium, mais ne peut pas prétendre à une bonne définition, à cause[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean BARRIOL : Correspondant de l'Institut. Professeur émérite à l'Université Nancy
Classification
Pour citer cet article
Jean BARRIOL. DIPOLAIRES MOMENTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 236 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire etmoment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 447 mots
- 6 médias
Deux charges opposées localisées en des points distincts constituent un dipôle électrique. Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. - Afficher les 9 références
Voir aussi
- DIPÔLE, électricité
- CHAMP ÉLECTRIQUE
- POLARISATION, électricité
- PERMITTIVITÉ, électricité
- INDICE DE RÉFRACTION
- CLAUSIUS-MOSSOTTI RELATION DE
- LIQUIDE ÉTAT
- LOGES MÉTHODE DES
- DEBYE, unité
- POLARISABILITÉ MOLÉCULAIRE
- POLAIRES MOLÉCULES
- CHARGE ÉLECTRIQUE
- FONCTION D'ONDE
- LCAO (linear combinations of atomic orbitals)
- CONSTANTE DIÉLECTRIQUE
- GAZEUX ÉTAT
- DÉPLACEMENT ÉLECTRIQUE ou INDUCTION ÉLECTRIQUE
- ÉLECTRONIQUE STRUCTURE
- MOMENT ÉLECTRIQUE