DIPOLAIRES MOMENTS
Article modifié le
Lorsque, dans une molécule ou dans une liaison chimique, les barycentres des charges électriques positives et négatives ne coïncident pas, la juxtaposition de ces charges opposées porte le nom de dipôle électrique. On dit encore que la molécule ou la liaison possède un moment dipolaire. Ce moment est un vecteur dont on sait seulement déterminer expérimentalement le module. Cette mesure donne des renseignements sur la configuration géométrique des molécules et le caractère ionique ou non de leurs liaisons de valence.
L'étude des moments dipolaires est inséparable de celle de la constante diélectrique, ou permittivité, dans des champs de différentes fréquences, qui mettent en évidence des phénomènes d'absorption conditionnant la relaxation diélectrique. Par ailleurs, la polarité des molécules détermine les forces moléculaires à l'état liquide et les grandeurs thermodynamiques qu'elles gouvernent (constantes critiques, chaleur de vaporisation, température d'ébullition, etc.).
La polarité des molécules
D'un point de vue formel, le problème général des interactions entre molécules chimiques comporte deux étapes : le calcul du champ électrique produit par une molécule en un point extérieur, puis l'action de ce champ électrique sur une autre molécule. Le traitement rigoureux de chaque question exige la connaissance précise, rarement atteinte, de la distribution des charges électriques dans chaque molécule. On peut, le plus souvent, se contenter d'une solution approchée en caractérisant la molécule par un vecteur, son moment de dipôle électrique.
Cette notion se précise si on considère le système des forces fappliquées à une molécule plongée dans le champ électrique E, et si on assimile cette molécule à un ensemble de charges ponctuelles qj de positions définies par les vecteurs rj. La résultante générale de ce système de forces, F = Σfj = EΣqj, est nulle dans le cas d'une molécule électriquement neutre, de sorte que l'action d'ensemble du champ se réduit à un couple caractérisé par le moment résultant :
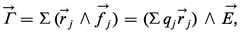
Le moment permanent μ0 peut être nul pour certaines molécules ; lorsqu'il n'en est pas ainsi, on dit qu'il s'agit de molécules polaires. La distinction entre molécules polaires et non polaires intervient pour l'ensemble des propriétés de la matière.
Les molécules polaires sont donc caractérisées par leur dipôle permanent μ0, c'est-à-dire par un système de deux charges opposées + q et − q, dont la distance a est de l'ordre de grandeur des dimensions moléculaires. La charge q a une grandeur voisine de la charge élémentaire, de sorte que μ0 = qa, exprimé dans l'ancien système d'unités u.e.s., est de l'ordre de 10-18. En conséquence, l'unité usuelle de moment dipolaire, le debye (D), a été choisie telle que 1 D = 10-18 u.e.s. = 3,335 64 . 10-30 coulomb . mètre (unité SI). La décomposition μ0 = qa est sans intérêt, sauf pour le calcul théorique à partir de la distribution des charges ; le moment μ0 est la seule grandeur accessible à l'expérience et intervient par son module, sa direction par rapport à la molécule et son sens, qu'on note habituellement en prenant le pôle positif comme origine : H−Cl. Les moments en phase gazeuse[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean BARRIOL : Correspondant de l'Institut. Professeur émérite à l'Université Nancy
Classification
Médias
Autres références
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 236 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire etmoment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 447 mots
- 6 médias
Deux charges opposées localisées en des points distincts constituent un dipôle électrique. Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. - Afficher les 9 références







