DIPOLAIRES MOMENTS
- Article mis en ligne le
- Modifié le
- Écrit par Jean BARRIOL
Mise en évidence et mesure du moment permanent
La grandeur physique la plus directement gouvernée par la présence d'un moment moléculaire permanent est la constante diélectrique relative εr, ou permittivité relative, qui définit l'accroissement de la capacité d'un condensateur électrique lorsqu'on remplit de matière l'espace entre les armatures. La relation entre εr et le moment électrique s'établit par l'intermédiaire du moment électrique par unité de volume, ou polarisation électrique P, de la substance. Cette polarisation entraîne l'augmentation de la densité de charge électrique σ′ des armatures, de manière à conserver le même champ électrique E qu'en l'absence de matière, qui correspond à la densité σ. La relation σ′ − P = σ ou σ′ = σ + P s'écrit, en introduisant l' induction électrique D :
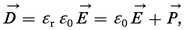
La polarisation électrique P s'interprète comme la somme des contributions moyennes μ des molécules, au nombre de N par unité de volume, soit P = Nμ, d'où la relation générale :
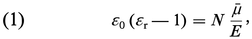
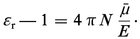
Le moment électrique moyen μ peut ainsi être obtenu à partir de εr déterminable expérimentalement, et la théorie des diélectriques a pour objet de relier μ au moment permanent μ0 et au moment induit μi définis ci-dessus.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean BARRIOL : Correspondant de l'Institut. Professeur émérite à l'Université Nancy
Classification
Pour citer cet article
Jean BARRIOL. DIPOLAIRES MOMENTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 236 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire etmoment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 447 mots
- 6 médias
Deux charges opposées localisées en des points distincts constituent un dipôle électrique. Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. - Afficher les 9 références





