MÉTAUX Métaux alcalins
Les métaux alcalins – lithium, sodium, potassium, rubidium, césium et francium – constituent les éléments de la première colonne du tableau de classification périodique. Ils doivent leur nom à la propriété qu'ils ont de donner avec l'eau des bases fortes, ou « alcalis ». Cette famille chimique est particulièrement homogène ; les propriétés des différents métaux varient peu de l'un à l'autre, et toujours dans le même sens, lorsqu'on passe du plus léger au plus lourd.
Les bases alcalines, hydroxyde ou carbonate, sont connues depuis la haute antiquité, et mention en est faite dans l'Ancien Testament. Les mots d'origine arabe « alcali » et « soda », comme le mot égyptien « natron », d'où est issu le symbole Na de l'élément sodium, ou le mot d'origine germanique potasse (Pottasche = cendres de pot), désignent, à l'origine, des produits semblables, mélanges complexes contenant essentiellement des carbonates de sodium et de potassium, extraits des cendres des végétaux. Dès 1807, Humphry Davy isole les métaux par électrolyse de la soude et de la potasse fondues. Dans les années qui suivent, la grande industrie chimique prend son essor grâce à la fabrication du carbonate de sodium, par le procédé Leblanc, puis par le procédé Solvay. L'importance économique de ces composés n'a pas diminué depuis.
Les métaux alcalins constituent une part importante de la croûte terrestre, puisque l'on a évalué à 2,4 p. 100 la teneur de celle-ci en sodium et à 2,1 p. 100 la teneur en potassium. Le potassium est souvent très dispersé dans les roches (feldspaths, micas, granites), mais se trouve aussi en énormes gisements sous forme de chlorures, associés à des sels de sodium et de magnésium, notamment à Stassfurt, en Allemagne. Les quantités les plus importantes de sodium existent à l'état de sels dissous dans les eaux des mers et des océans, où le titre, en grammes de chlorure par litre d'eau, varie d'environ 8,5 dans la Baltique, très peu salée, à 79,5 dans la mer Morte. Le potassium accompagne toujours le sodium dans une proportion voisine de 1/30. Les autres métaux alcalins sont plus rares, mais existent souvent en petite quantité à côté du sodium et du potassium.
Tous les êtres vivants ont besoin de sodium et de potassium pour se développer normalement. À l'image de l'eau de mer, les liquides extracellulaires sont généralement riches en sodium et pauvres en potassium, alors que ce rapport est inversé si l'on considère la composition des milieux cellulaires. Les végétaux contiennent beaucoup plus de potassium que de sodium, d'où l'importance des engrais potassiques.
Propriétés
Ionisation
Les atomes alcalins possèdent un cortège électronique, composé d'un ensemble de couches internes inertes, ayant la structure d'un gaz rare, et d'un électron supplémentaire, ou électron de valence, qui gravite sur une orbitale de type s. L'étude des potentiels d'ionisation montre que cet électron s'arrache facilement, l'ionisation demandant d'autant moins d'énergie que l'atome est plus lourd. La chimie des métaux alcalins est essentiellement constituée par l'étude du passage à l'état ionisé M+ et par celle des propriétés de cet ion. La plupart des composés alcalins possèdent donc une structure purement ionique ; cette particularité, jointe au fait que les édifices ioniques les plus stables sont constitués par des ions de volume semblable, permet de prédire qu'en règle générale les hydrures, nitrures, carbures et oxydes simples, c'est-à-dire les composés possédant des anions assez petits, seront d'autant plus stables que le métal alcalin sera plus léger, alors que les sels correspondant à de gros anions, peroxydes (O − O)2-, superoxydes[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. MÉTAUX - Métaux alcalins [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :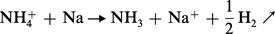
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








