MÉTAUX Métaux alcalins
Les composés alcalins
La stabilité des hydrures alcalins croît avec le numéro atomique. L'hydrure de lithium possède une stabilité exceptionnelle. Fondu, il conduit l'électricité et, par électrolyse, on recueille de l'hydrogène à l'anode, ce qui permet d'affirmer l'existence d'une structure Li+H-. Ce composé s'obtient facilement en faisant passer un courant d'hydrogène sur du métal légèrement chauffé. La préparation des autres hydrures est plus délicate. On remarque une augmentation de masse volumique sensible entre le métal et l'hydrure, ce qui suppose une contraction de volume, qui peut atteindre 44 p. 100 dans le cas du césium, au cours de la réaction entre le métal et l'hydrogène. La combinaison directe du métal et de l'azote n'a lieu que dans le cas du lithium pour conduire au nitrure Li3N dès la température ordinaire.
Les oxydes normaux de type M2O ne se préparent pas facilement par oxydation directe, et seul celui du lithium est assez usuel. Les alcalins lourds donnent plutôt des composés plus riches en oxygène. Le produit de la combustion du sodium est principalement le peroxyde Na2O2 ; celui de la combustion des alcalins lourds, le superoxyde, comme KO2. L'étude complète du système césium-oxygène met en outre en évidence plusieurs sous-oxydes : Cs7O, Cs4O, Cs7O2. Les peroxydes libèrent de l'eau oxygénée par action des acides ou de l'eau :

En milieu basique, l'eau oxygénée, instable, libère son oxygène, ce qui permet d'utiliser le peroxyde de sodium, sous le nom d'oxylithe, pour préparer de petites quantités de ce gaz par simple adjonction d'eau. Les oxydes, comme les hydroxydes et de nombreux composés alcalins, possèdent des chaleurs de formation qui dépassent souvent quatre cents kilojoules par mole de métal, ce qui les rend thermiquement stables et très difficiles à réduire. L'existence de composés de type M2O2 et MO2 ne doit pas faire penser que les métaux alcalins possèdent parfois un degré d'oxydation de 2 ou 4 ; en effet, la structure de ces oxydes fait apparaître des ions (O2)2- dans les peroxydes et (O2)- dans les superoxydes ; le cation a toujours la structure M+ ; les ions négatifs dérivent directement de la molécule O2.
Les hydroxydes alcalins, hygroscopiques et déliquescents, sont des bases fortes solubles ; à la différence des hydroxydes alcalino-terreux, peu solubles, on ne peut les déshydrater par chauffage, car ils fondent sans décomposition. La dissolution dans l'eau s'effectue avec un dégagement de chaleur important ; les solutions diluées sont totalement ionisées. Par électrolyse des hydroxydes fondus, on prépare usuellement les métaux. Lors de l'électrolyse de la solution aqueuse, c'est l'eau qui se décompose en oxygène et hydrogène.
Les halogénures, très répandus à l'état naturel, cristallisent dans deux types de structures cubiques. Lorsque le cation est sensiblement plus petit que l'anion, c'est-à-dire dans tous les cas, le césium excepté, la structure est cubique à faces centrées, selon le type du chlorure de sodium (fig. 1) ; lorsque la taille du cation croît, la structure devient cubique centré ; c'est le type du chlorure de césium. De nombreux composés minéraux cristallisent suivant ces structures types.
Les sels de l'acide carbonique constituent une famille double : les hydrogénocarbonates ou bicarbonates, insolubles, et les carbonates neutres, solubles, de formules MHCO3 et M2CO3. Ces deux groupes de composés ont une réaction basique due aux phénomènes d'hydrolyse en solution, puisque ce sont des sels d'une base forte avec un acide faible. Le carbonate de lithium se distingue des autres par sa faible solubilité.
En règle générale, les sels alcalins sont solubles, à quelques exceptions près, qui ont un intérêt analytique[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. MÉTAUX - Métaux alcalins [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :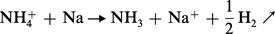
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références










