MÉTAUX Métaux alcalins
Spectres des métaux alcalins
Lorsqu'on introduit dans le charbon d'un arc électrique, ou plus simplement dans la flamme d'un bec Bunsen, un métal alcalin ou l'un de ses sels, l'arc ou la flamme prennent une couleur caractéristique du métal considéré : rouge intense pour le lithium, jaune pour le sodium, violet pour le potassium, le rubidium et le césium. Les spectres émis sont composés de raies fines qui ont permis, en 1861, de caractériser le rubidium et le césium, jusqu'alors inconnus, et dont les noms rappellent la couleur de la raie la plus intense du spectre.
L'examen du spectre d'arc d'un métal alcalin permet de grouper en séries les raies qui présentent des caractères communs : raies plus ou moins fines, et mode de décomposition identique dans un champ magnétique. À l'intérieur d'une même série, lorsque la longueur d'onde croît, les raies se resserrent pour tendre vers une limite et, en même temps, leur intensité s'affaiblit. Un examen plus détaillé de chaque raie montre que celle-ci se divise en deux : chaque raie est un doublet.
En première analyse, on peut comparer un atome alcalin à l'atome d'hydrogène ; l'ensemble noyau et électrons des couches profondes, portant globalement une charge positive unité, est équilibré par la charge négative unité de l'électron (approximation hydrogénoïde). Cet électron périphérique peut, sous l'effet d'une excitation, quitter son orbite pour d'autres qui possèdent des niveaux d'énergie supérieurs, puis retomber à un niveau d'énergie plus bas avec émission lumineuse ; la radiation émise caractérise l'écart d'énergie qui existe entre le niveau initial et le niveau final. L'énergie d'une radiation est numériquement égale au produit de sa fréquence par la constante de Planck : E = hv. Les spectroscopistes notent les différentes raies par leur nombre d'onde σ égal à l'inverse de la longueur d'onde. Ils ont cherché à calculer le nombre d'onde de chaque raie par la différence entre deux termes spectraux comme dans le cas du spectre de l'hydrogène. Les termes obtenus pour les quatre séries de raies découvertes sont plus complexes que ceux de l'hydrogène et peuvent s'écrire :

Chaque série de termes spectraux, notée mS, mP, mD ou mF, correspond à une valeur particulière du nombre quantique azimutal k ou plutôt du nombre quantique secondaire l = k − 1. Pour mS, k = 1, c'est-à-dire l = 0, puis k prend des valeurs 2, 3, 4, et l, corrélativement, les valeurs 1, 2, 3.
Il y a émission lumineuse lorsque l'électron passe d'un niveau énergétique à un autre. Le nombre d'onde de la raie émise est déterminé par la différence des termes spectraux des deux niveaux. Les passages entre deux niveaux ne sont possibles que lorsque les deux termes spectraux correspondent à des nombres quantiques secondaires différents de 1 unité ; ce qui revient à dire que le moment cinétique de l'électron ne peut varier que de h/2π.
L'application de cette règle permet de retrouver[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. MÉTAUX - Métaux alcalins [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :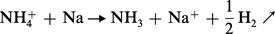
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








