DÉTERGENTS
La détergence est définie comme « le nettoyage de la surface d'un objet solide, au moyen d'un bain où se trouve un agent spécial, le détergent, suivant un processus impliquant une action physico-chimique autre que la simple dissolution ». À l'échelle mondiale, le marché des détergents est caractérisé par la disparité entre pays riches et pays en développement. Dans le premier cas, les produits sont sophistiqués et chers, mais le marché stagne. Dans le second cas, les formulations sont moins compliquées, leurs prix sont bas avec cependant un très fort potentiel d'augmentation de volume. Beaucoup d'innovations ont été réalisées dans la seconde moitié du xxe siècle. Cependant, si les fabricants de détergents et les fournisseurs de matières premières veulent assurer leur pérennité, de nouvelles molécules devront être développées afin de répondre aux besoins des consommateurs et de respecter davantage l'environnement.
Histoire
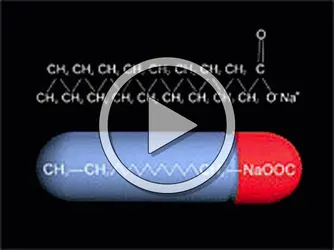
Savons et détergents
Planeta Actimedia S.A.© Encyclopædia Universalis France pour la version française.
Le savon, dont une recette de fabrication a été retrouvée sur des tablettes sumériennes (1 500 av. J.-C.), est longtemps resté un produit de luxe. Ce n'est qu'au xiiie siècle que, en France, on commença à le produire industriellement à partir de cendres de hêtres et de suif de chèvre, remplacé deux siècles plus tard par l'huile d'olive. En 1823, le chimiste français Eugène Chevreul (1786-1889) découvrit que le savon résulte d'une réaction chimique entre les alcalis et les triglycérides, la saponification. De nombreuses fabriques se développèrent alors dans la région méditerranéenne et le célèbre « savon de Marseille » vit le jour. Au début du xxe siècle, les premières formules de détergents contenant à la fois du silicate de sodium pour adoucir l'eau et du perborate de sodium pour éliminer les taches colorées furent réalisées en Allemagne. Par la suite, furent élaborés des produits de synthèse tels que les sulfates d'alcools gras. Pendant la Seconde Guerre mondiale, la pénurie de graisses animales et végétales favorisa le développement des produits dérivés du pétrole. En 1946 apparut une nouvelle matière première, l'alkylbenzène sulfonate de sodium ou ABS, qui devint le tensioactif de synthèse le plus « célèbre » après le savon. D'autres molécules, comme les alcools gras polyéthoxylés, furent ensuite développées. Au début des années 1960, sous la pression écologique, l'ABS, peu biodégradable, fut remplacé par l'alkylbenzène sulfonate linéaire ou LAS. Parallèlement, des agents complexants efficaces furent introduits : les triphosphates ou tripolyphospates (TPP) puis, en raison de contraintes environnementales édictées dans certains pays, les zéolites. Les formulations actuelles, plus sophistiquées et plus performantes, contiennent des agents antiredéposition, des azurants optiques, des agents de contrôle de la mousse, des enzymes, des polymères, des activateurs de blanchiment. Les formes des produits ont également subi certains changements. Ainsi, les poudres conventionnelles ont peu à peu été supplantées par les lessives liquides, les poudres concentrées, les tablettes et les capsules.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Louis HO TAN TAÏ : ingénieur consultant
- Véronique NARDELLO-RATAJ : docteur de l'université de Lille-I, professeur des Universités
Classification
Pour citer cet article
Louis HO TAN TAÏ et Véronique NARDELLO-RATAJ. DÉTERGENTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ANTIBIOTIQUES
- Écrit par Aurélie CHABAUD, Sylvain MEYER, Marie-Cécile PLOY
- 6 760 mots
- 6 médias
Quant aux détergents, ce sont des produits nettoyants qui décollent les souillures de leur substrat. Ils sont destinés aux surfaces et matériaux inertes. Ils ne contiennent pas d’agent antibactérien mais contribuent à l’élimination de bactéries et du biofilm bactérien par le décollement et la dissolution... -
COLLOÏDES
- Écrit par Didier ROUX
- 6 009 mots
L'application industrielle la plus importante des solutions colloïdales stables concerne le domaine des détergents. Dissoudre des corps hydrophobes (graisses, poussières, pigments, etc.) est la caractéristique des solutions micellaires. Les propriétés de surface de ces solutions sont aussi importantes.... -
EXTRÉMOPHILES
- Écrit par Jacques DIETRICH, Jean GUEZENNEC
- 2 856 mots
C'est dans les années 1960 qu'est apparue la première protéase d'origine bactérienne dans les lessives. La recherche s'est ensuite orientée vers d'autres types de protéases, mais également de lipases (pour les taches dues aux huiles et aux graisses), d'amylases (nettoyage des taches produites par... -
INTERFACES
- Écrit par Simone BOUQUET, Jean-Paul LANGERON
- 8 287 mots
- 8 médias
Un corps tensioactif peut également conférer à un liquide un pouvoir mouillant vis-à-vis du solide s'il peut s'y lier. C'est ainsi qu'un détergent, dont la queue hydrophobe peut adhérer au tissu, va également se fixer sur les particules de graisse déposées sur celui-ci. Les têtes hydrophiles tendent...
Voir aussi
- TEXTILES FIBRES
- ENZYMES
- LESSIVES
- CMC (concentration micellaire critique)
- CHIMIQUES INDUSTRIES
- BLANCHIMENT
- LAVAGE
- EAU OXYGÉNÉE (peroxyde d'hydrogène)
- SAVONS
- ALKYLBENZÈNE SULFONATES
- TENSIOACTIVES SUBSTANCES
- TENSION SUPERFICIELLE
- AMPHIPHILE MOLÉCULE
- DÉGRAISSANTS
- PHOSPHATES
- SAPONIFICATION
- AZURAGE
- CHIMIE HISTOIRE DE LA
- PROTÉASES
- GRAISSES



