Savons et détergents
Planeta Actimedia S.A.© Encyclopædia Universalis France pour la version française.
Principes chimiques.
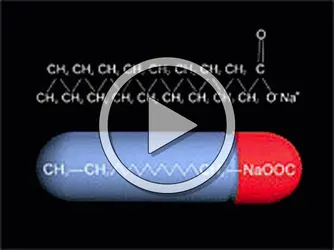
Les savons et détergents sont des sels sodiques et potassiques des acides gras supérieurs.
Leurs molécules comportent une «tête» polaire hydrophile, qui capte l'eau, et une «queue» composée d'une chaîne carbonée neutre hydrophobe, qui rejette l'eau et attire les graisses.
Lors d'une lessive, les têtes hydrophiles s'associent aux molécules d'eau dont elles affaiblissent les liens, ce qui réduit la tension superficielle et facilite le trempage du linge. Cette capacité tensioactive rend le savon très efficace pour l'élimination de la saleté.
Parallèlement, les queues hydrophobes se disposent autour des globules de graisse, qui se sont détachés du tissu du fait de l'agitation de la solution et qui flottent ainsi sous forme de petites particules enrobées de savon, appelées micelles.
Durant le lavage, les micelles acquièrent une charge électrique de même signe que le tissu, ce qui les empêche de s'y redéposer ou de s'agréger en particules plus grosses.
L'inefficacité des savons en eaux dures, fortement calcaires, a conduit à les remplacer par des détergents synthétiques, qui sont composés d'un tensioactif, appelé surfactant, et de phosphates, d'enzymes et de blanchissants optiques qui améliorent l'aspect du linge.