AMINES
Structure et propriétés physiques des amines aliphatiques
La structure électronique des amines aliphatiques est assez analogue à celle des alcools et des éthers ; les liaisons σ unissant l'azote au reste de la molécule sont polarisées par suite de l'électronégativité de l'azote sp3, supérieure à celle du carbone sp3 et de l'hydrogène ; cette polarisation est toutefois inférieure à celle des dérivés oxygénés. Elle entraîne, pour les amines primaires et secondaires, l'existence d'associations intermoléculaires par liaisons hydrogène, dont les conséquences sont de même nature, mais d'intensité plus faible, que pour les alcools : élévation de la température d'ébullition par rapport à celle des alcanes de même chaîne ; solubilité dans l'eau des premiers termes. Les amines primaires et secondaires présentent des bandes d'absorption infrarouge propres aux fréquences d'élongation NH libre (3 500-3 300 cm-1) et NH associé (3 100 cm-1).
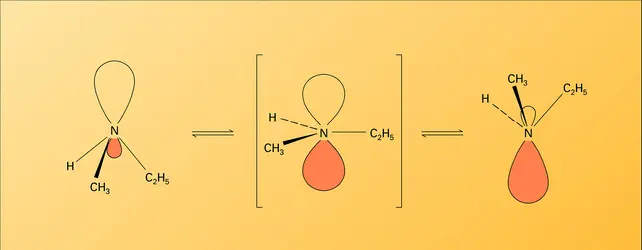
La géométrie des liaisons, autour de l'azote fonctionnel, est semblable à celle de l' ammoniac : hybridation sp3 de cet atome et structure tétraédrique, le doublet non partagé assurant la quatrième branche du tétraèdre. Comme dans le cas de l'ammoniac, cette structure n'est pas figée et le doublet non partagé vibre de part et d'autre du noyau d'azote, avec une fréquence de l'ordre de 103 à 105 s-1, ce qui exclut la possibilité d'isoler des énantiomères construits autour d'un atome d'azote asymétrique.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMINES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
...formée, se condense avec deux molécules de méthanal en un composé tétracyclique, ayant une structure analogue à celle de l'adamantane, l'hexaméthylènetétramine (réaction). Les aldéhydes et les cétones réagissent de même avec les amines primaires, en donnant des imines substituées, plus stables. -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
...réalisée au moyen de l'hydrure complexe LiAlH4 (NaBH4 ne réduit pas) : on obtient les amines primaires, secondaires et tertiaires de même squelette (réactions 19). La réduction par le sodium et l'alcool (réaction de Bouveault et Blanc) conduit à un mélange d'alcool et d'amine. -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Universalis, Pierre KAMOUN
- 3 486 mots
- 6 médias
Detrès nombreuses réactions utilisent la réactivité de la fonction amine : elles sont particulièrement utilisées pour marquer les groupements NH2 terminaux des peptides ou protéines. C’est également sur des groupements NH2 que l’on peut greffer des marqueurs de nature diverse, fluorescents... -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
L' aniline est un composé organique renfermant une fonction amine primaire, c'est-à-dire un atome d'azote lié à un carbone et à deux hydrogènes ; l'atome de carbone appartenant à un noyau benzénique, il s'agit d'une amine aromatique, la plus simple de toutes. Elle a pour formule...
- Afficher les 13 références
Voir aussi
- BASE, chimie
- SUBSTITUTION, chimie
- SOLVATATION
- HYDROGÉNATION
- CÉTONES
- ALIPHATIQUES ou ACYCLIQUES COMPOSÉS
- ADDITION, chimie
- ALKYLATION ou ALCOYLATION
- ACYLATION
- ALDÉHYDES
- HOFMANN RÉACTION D'
- OXYDATION
- NUCLÉOPHILES SUBSTITUTIONS
- HALOGÉNATION
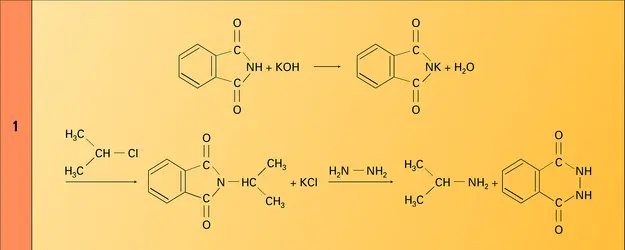
- GABRIEL MÉTHODE DE
- AMINES AROMATIQUES ou ARYLAMINES
- AMMONIUM QUATERNAIRE
- SENDERENS RÉACTION DE
- CHLOROFORME
- NOMENCLATURE, chimie
- RÉDUCTION, chimie
- NITREUX ACIDE
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE