NICKEL
Propriétés
Propriétés physico-chimiques
Le nickel occupe le huitième groupe de transition avec le fer et le cobalt. Sa masse atomique est de 58,71 et il possède 5 isotopes stables, dont 58Ni (67,76 p. 100), et 7 isotopes radioactifs identifiés, dont le nickel 78.
Le nickel est un métal blanc brillant, relativement dur, malléable et ductile, de densité 8,90 à 20 0C. Il fond à 1 453 0C et bout à environ 2 800 0C. Il cristallise dans le réseau cubique à face centrée (a = 0,352 nm à 20 0C) et il est ferro-magnétique jusqu'à 355 0C (point de Curie).
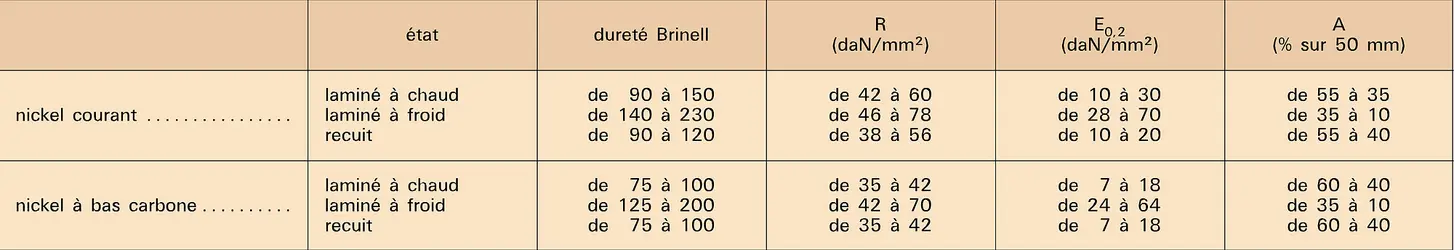
Les principales caractéristiques physiques et mécaniques des nickels industriels sont indiquées dans les tableaux.
Le nickel s'oxyde difficilement à l'air, car il est protégé par une mince couche d'oxyde. Il résiste bien à la corrosion par l'eau distillée et par l'eau de ville, même à la température de 260 0C sous une pression de 136 atm ; l'eau de mer en mouvement est presque sans action, mais l'eau de mer stagnante peut le corroder localement.
Le nickel est peu éloigné de l'hydrogène dans l'échelle des forces électromotrices de dissolution (— 0,5 V) ; il se polarise facilement et les produits de sa corrosion sont généralement peu solubles ; il résiste donc bien aux acides non oxydants et non aérés. Au contraire, dans les acides oxydants tels que l'acide nitrique, il se corrode rapidement. Il est peu attaqué par les solutions salines ou alcalines non oxydantes, de même que par la plupart des acides et des composés organiques que l'on rencontre dans l'industrie alimentaire.
Il résiste particulièrement bien à la soude et à la potasse à des concentrations supérieures à 75 p. 100 et à des températures de plus de 400 0C.
Il résiste bien aux halogènes secs et à leurs hydracides, même à des températures de 450 à 500 0C.
Aux températures élevées, le nickel se comporte bien en atmosphère oxydante ou réductrice, mais ne peut être utilisé en présence de composés sulfureux au-dessus de 325 à 350 0C.
L'isotope 78 du nickel
Pour les physiciens nucléaires, le noyau de l'isotope 78 du nickel est très particulier. Ils l'appellent même « doublement magique », car son nombre de protons (28) et son nombre de neutrons (50) sont tous les deux caractéristiques de couches complètes (comme il en va des atomes nobles tels l'argon ou le néon dont toutes les couches électroniques sont complètes). Son grand intérêt scientifique vient de son extrême importance dans les processus de nucléosynthèse des éléments plus lourds que le fer. On pense en effet que le processus dominant, appelé processus r (pour rapide), est un enrichissement progressif en neutrons qui a lieu lors de l'explosion d'étoiles. Par ses propriétés, le nickel 78 pourrait ralentir considérablement ce processus ou même le rendre inopérant. Il importait donc de mieux connaître certaines caractéristiques essentielles de ce noyau, et en particulier sa durée de vie moyenne. Malheureusement, ce noyau instable semble avoir pratiquement disparu de l'Univers et il est très difficile à produire artificiellement.
Des spécimens du nickel 78 fabriqués à l'aide d'un cyclotron supraconducteur ont permis, en 2005, de mesurer leur durée de vie moyenne : 110 millisecondes, soit quatre fois moins que ne le laissaient prévoir les estimations théoriques. Ainsi, le nickel n'est pas autant qu'on le croyait responsable de la difficulté de la nucléosynthèse des éléments lourds.
Utilisations
Le nickel non allié est utilisé à l'état massif ou sous forme de plaqués de nickel dans l'industrie chimique, notamment en présence de soude, et pour les chlorations organiques. On l'utilise aussi dans l'électronique et pour les pièces de monnaie.
Le[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques GRILLIAT : ingénieur au Centre national des arts et métiers
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
- Michel RABINOVITCH : ingénieur géologue
- Jacques SALBAING : directeur technique et commercial de l'International Nickel France
Classification
Pour citer cet article
Jacques GRILLIAT, Bernard PIRE, Michel RABINOVITCH et Jacques SALBAING. NICKEL [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le nickel trouve également de très fréquents emplois dans les aciers alliés. Il présente deux différences essentielles avec le chrome : il se dissout dans la ferrite et ne forme pas de carbures ; il abaisse le point de transformation α → γ, mais non γ → δ, de sorte que le domaine d'existence de l'austénite... -
AIMANTS
- Écrit par Roger FONTAINE
- 6 273 mots
- 13 médias
-
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
-
CADMIUM
- Écrit par Alexandre TRICOT
- 8 050 mots
- 6 médias
Des hydroxydes de cadmium et de nickel mis en tubes ou en plaques et baignés dans un électrolyte, forment un élément susceptible d'être chargé électriquement puis déchargé. L'électrolyte est une solution aqueuse de potasse, d'où son nom d'alcalin. - Afficher les 25 références
Voir aussi
- ACIERS INOXYDABLES
- ISOTOPES
- NOYAU ATOMIQUE
- CUPRONICKELS
- GISEMENTS MÉTALLIFÈRES
- CUPROALUMINIUMS
- ALTÉRATION DES ROCHES
- EXTRACTION, métallurgie
- CATALYSEURS
- AFFINAGE, métallurgie
- ACIER, technologie
- DURÉE DE VIE ou VIE MOYENNE, physique
- SULFATES
- FONTE
- RÉSISTANCE À LA CORROSION
- SUPERALLIAGES
- MAILLECHORTS
- MONEL
- CRONSTEDT AXEL FREDRIK (1722-1765)
- CUIRASSE, pédologie
- TRANSITION MÉTAUX DE
- FERRONICKEL
- OXYDES
- CHLORURES
- NITRATES
- INTRUSION, géologie
- REVÊTEMENT MÉTALLIQUE