MÉTAUX Métaux alcalino-terreux
Propriétés chimiques des alcalino-terreux et de leurs composés
Les métaux alcalino-terreux possèdent une grande réactivité chimique ; essentiellement réducteurs, ils s'unissent facilement avec la plupart des corps simples. Il est nécessaire de les conserver sous une couche d'huile minérale ou de pétrole, car à l'air, surtout humide, leur surface se ternit très rapidement, par suite de l'apparition d'une croûte d'oxyde, d'hydroxyde, et de carbonate. Dès la température ambiante, mais surtout vers 450 0C, ces métaux absorbent l'azote avec formation d'un nitrure, thermiquement très stable, sauf dans le cas du béryllium. Ces composés s'hydrolysent facilement avec dégagement d' ammoniac et dépôt d'hydroxyde :
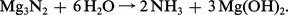
Les métaux alcalino-terreux absorbent donc à la fois l'azote et l'oxygène à température assez basse. Ces deux gaz étant les constituants les plus importants de l'atmosphère, il ne subsiste que les gaz nobles dans une ampoule de verre pleine d'air, contenant du magnésium ou du calcium en copeaux, chauffée au rouge. Cette expérience simple permet à la fois la mise en évidence et la préparation des constituants inertes de l'air.
Les métaux alcalino-terreux se dissolvent dans l'ammoniac liquide, avec formation d'une solution bleue. Après évaporation du solvant en excès, il subsiste un résidu de couleur cuivrée, dont la formule répond à celle d'un ammoniacate défini M(NH3)6 ; par chauffage progressif, ces produits se transforment successivement en amidure M(NH2)2, puis en imidure MNH. L'action du gaz ammoniac sur les métaux chauffés conduit à un mélange de nitrure et d'hydrure.
Les métaux alcalino-terreux donnent une famille de composés intéressante avec le carbone et l'azote. Le traitement de la chaux par le charbon au four électrique, donne le carbure de calcium, qui reste une source d' acétylène :
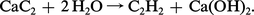

Dans les mêmes conditions, les alcalino-terreux lourds ne donnent pas une cyanamide, mais un cyanure comme le cyanure de baryum Ba(CN)2.
Lorsqu'on traite un halogénure de métal léger par l'hydrure de lithium, ou directement le métal par l'hydrogène, on obtient un hydrure. L'absorption du gaz hydrogène par le métal présente des caractères exceptionnels et, dans le cas du calcium, la réaction se fait encore à la température de la carboglace (anhydride carbonique à l'état solide) : − 80 0C. L'hydrure de calcium est le plus stable de tous, mais sa stabilité est quand même inférieure à celle de l'hydrure de lithium. Assez difficiles à décomposer par la chaleur, ces hydrures s'hydrolysent facilement, avec dégagement d'hydrogène. L'hydrure de calcium a été employé à cette fin pendant la Première Guerre mondiale, sous le nom d'hydrolithe.
Les chaleurs de formation des oxydes, rapportées à une mole de métal, sont particulièrement importantes ; cela traduit une grande stabilité thermique, confirmée par des points de fusion très élevés. Ces oxydes sont utilisés comme réfractaires ; leur réduction est souvent industriellement impossible. Ils s'unissent à l'eau, de façon réversible, pour donner un hydroxyde peu soluble :
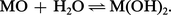
Ces caractères les différencient des hydroxydes alcalins (soude, potasse) très solubles et fusibles sans déshydratation. Les propriétés[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. MÉTAUX - Métaux alcalino-terreux [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :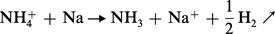
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








