AROMATICITÉ
Définitions de l'aromaticité
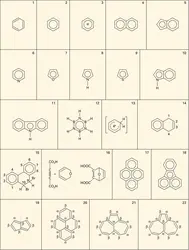
Dans les divers exemples étudiés, le caractère aromatique commun à toutes ces molécules se manifestait à des degrés divers. Dans le benzène, il atteignait son maximum d'intensité, mais dans les autres molécules benzéniques, il était quelque peu atténué, dans les hétérocycles on observait une diminution progressive de l'aromaticité quand on passait du thiophène au pyrrole et au furanne. Il serait donc intéressant de trouver un critère qui permette de savoir non seulement si une molécule est aromatique ou non mais aussi, éventuellement, à quel degré elle l'est.
La première tentative fondée sur la structure électronique est due à Hückel qui énonça la règle suivante : « Une molécule est aromatique si le nombre d'électrons π qu'elle contient est de la forme 4 n + 2, n étant un entier positif. » Le benzène, tous les carbures benzéniques (naphtalène, anthracène), l'azulène satisfont à cette règle, de même les hétérocycles comme la pyridine, le furanne, le pyrrole ou le thiophène. Cette règle lui permit de prévoir l'aromaticité des ions C5H−5 et C7H+7 avant même leur découverte. Malheureusement, cette règle rencontre des difficultés, par exemple pour le pyrène (formule 17) que l'ensemble des propriétés indique comme aromatique et qui possède 16 électrons. Pour résoudre la difficulté, on peut modifier l'énoncé de la règle en ne considérant que les électrons portés par les atomes périphériques (soit 14, ici), responsables des réactions de substitution. Malgré cela, toutes les difficultés ne sont pas réglées, puisque le carbure aromatique représenté par la formule 18 ne satisfait pas à la règle, même modifiée.
On peut aussi songer à s'adresser à l'énergie de conjugaison pour chiffrer l'aromaticité, puisque la stabilité de ces molécules est une des manifestations les plus frappantes de l'aromaticité. Mais des difficultés apparaissent : en effet, l'énergie de conjugaison du naphtalène est supérieure à celle du benzène, bien qu'il soit moins aromatique. Il en est de même lorsqu'on considère le couple azulène-naphtalène.
Craig a proposé une règle fondée sur la symétrie de la molécule. Elle ne s'applique qu'à des molécules qui possèdent un plan de symétrie. Pour savoir si une molécule est aromatique, on écrit sa formule de Kekulé, on marque chaque extrémité des doubles liaisons des signes α et β de façon que l'on ait le moins de signes de même espèce au contact. Soit f le nombre de paires d'atomes qui s'échangent dans une symétrie par rapport au plan de symétrie, et soit g le nombre de couples de symboles α et β qui s'échangent dans la symétrie.
La molécule sera aromatique si f + g est pair. Exemple :
Pentalène (formule 19) f = 3, g = 0,f + g = 3, non aromatique.
Pyrène (formule 20) f = 6, g = 0, f + g = 6, aromatique.
Mais des difficultés apparaissent lorsque l'on peut écrire plusieurs formes de Kekulé. Par exemple pour l'hydrocarbure de Hafner :
Selon la formule 21 f = 6, g = 1, f + g = 7, non aromatique.
Selon la formule 22 f = 6, g = 2, f + g = 8, aromatique.
On élude le problème en disant qu'une telle molécule est pseudo-aromatique. Mais de toute façon la règle de Craig, pas plus que celle de Hückel, ne peut distinguer le degré d'aromaticité dans les hydrocarbures pour lesquels la somme f + g est paire comme dans les benzéniques où pourtant des différences sensibles apparaissent. La raison de leur échec réside dans le fait qu'elles se sont éloignées de l'idée que suggère l'expérience : l'aromaticité est liée à une uniformisation des propriétés des liaisons, nous ajouterons même des liaisons périphériques qui sont les responsables de la réactivité. Comme critère, nous pouvons[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Pour citer cet article
André JULG. AROMATICITÉ [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'acylation des aromatiques par les chlorures d'acides en présence de chlorure d'aluminium est l'une des façons les plus générales d'obtenir des arylcétones ( réactions d'acylation de Friedel et Crafts). Le chlorure d'aluminium complexe le chlorure d'acide et le transforme en excellent électrophile... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Les amines aromatiques primaires, secondaires et tertiaires sont des dérivés de l'ammoniac dont un hydrogène au moins est remplacé par un reste aromatique. Le représentant le plus important de cette famille est l' aniline ou monoaminobenzène. -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
L' aniline est un composé organique renfermant une fonction amine primaire, c'est-à-dire un atome d'azote lié à un carbone et à deux hydrogènes ; l'atome de carbone appartenant à un noyau benzénique, il s'agit d'une amine aromatique, la plus simple de toutes. Elle a pour formule...
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
- Afficher les 30 références
Voir aussi
- BUTADIÈNE
- ORBITALES ATOMIQUES
- DÉLOCALISATION ÉLECTRONIQUE
- SUBSTITUTION, chimie
- CYCLIQUES COMPOSÉS
- CHARGE ÉLECTRIQUE
- BORAZOLE
- FONCTION D'ONDE
- HYPSOCHROME EFFET
- HÜCKEL RÈGLE DE
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- ÉNERGIE DE CONJUGAISON ou ÉNERGIE DE RÉSONANCE, chimie
- ADDITION, chimie
- BATHOCHROME EFFET
- CRAIG RÈGLE DE
- AZULÈNE
- ÉNERGIE DE LIAISON
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉLECTRONIQUE STRUCTURE
- CONJUGAISON, chimie
- STABILITÉ, chimie
- SPECTRE D'ABSORPTION
- DENSITÉ ÉLECTRONIQUE