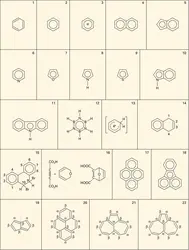
AROMATICITÉ
Propriétés générales des molécules aromatiques
Il résulte de ce qui précède que l'aromaticité est essentiellement liée à la délocalisation des électrons sur toute la molécule. Cette délocalisation entraîne un certain nombre de conséquences.
Aspect énergétique
Si les électrons ne restent pas localisés sur des doubles liaisons indépendantes, mais forment un nuage continu qui s'étend sur toute la molécule, c'est que l'énergie du système est plus basse dans ce dernier état. En d'autres termes, la conjugaison se traduit par une stabilisation du système. L'abaissement de l'énergie est appelé énergie de conjugaison (cette expression est synonyme d'énergie de résonance, mais doit lui être préférée).
Le cas du benzène a été particulièrement étudié. La chaleur dégagée par l'hydrogénation d'une double liaison bisubstituée, mais isolée, est de 112 kJ par mole. Si les trois doubles liaisons étaient indépendantes comme le veut la formule de Kekulé, la chaleur d'hydrogénation de la molécule de benzène serait de 336 kJ. Or, en réalité, elle n'est que de 208 kJ. C'est que l'énergie de la molécule réelle conjuguée est inférieure de 150 kJ à l'énergie de la formule hypothétique de Kekulé. On obtient le même résultat en considérant les chaleurs de combustion.
On notera que l'hexatriène :

À titre indicatif, on peut donner les énergies de conjugaison de quelques molécules aromatiques, énergies calculées à partir de la formule de Kekulé :
benzène150 kJ naphtalèneProblème sur une balise : pcond -
<pcond asc="_"/>Si le problème persiste, n'hésitez pas à contacter le service client Universalis, en précisant bien l'adresse URL de la page.
322 kJ anthracèneProblème sur une balise : pcond -
<pcond asc="_"/>Si le problème persiste, n'hésitez pas à contacter le service client Universalis, en précisant bien l'adresse URL de la page.
485 kJ azulèneProblème sur une balise : pcond -
<pcond asc="_"/>Si le problème persiste, n'hésitez pas à contacter le service client Universalis, en précisant bien l'adresse URL de la page.
192 kJProblème sur une balise : pcond -
<pcond asc="_"/>Si le problème persiste, n'hésitez pas à contacter le service client Universalis, en précisant bien l'adresse URL de la page.
Plus l'énergie de conjugaison est grande, plus le système est stable. Comme application, nous signalerons le cas de l'azulène et du naphtalène, qui sont isomères et dont les formules de Kekulé de référence ont même énergie puisqu'elles contiennent le même nombre de doubles et de simples liaisons. L'azulène est donc moins stable que le naphtalène, ce qui explique qu'une élévation de température en présence de catalyseur (soufre) le transforme en naphtalène.
Incidence sur la géométrie moléculaire
Nous avons vu que dans le benzène la délocalisation des électrons entraînait l'uniformisation des longueurs de liaisons. Ce phénomène est absolument général, mais l'uniformisation ne peut être aussi parfaite dans toutes les molécules où les liaisons occupent des positions respectives différentes. Par exemple, dans le naphtalène, les distances interatomiques sont (en nm) :

Dans l'azulène, les liaisons périphériques mesurent toutes approximativement 0,14 nm, mais la liaison binucléaire 0,147 nm. Dans le graphite, toutes les distances C − C sont évidemment égales : 0,142 nm.
Charges électroniques
On peut penser a priori que la délocalisation des électrons va se traduire par un déplacement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Pour citer cet article
André JULG. AROMATICITÉ [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
L'acylation des aromatiques par les chlorures d'acides en présence de chlorure d'aluminium est l'une des façons les plus générales d'obtenir des arylcétones ( réactions d'acylation de Friedel et Crafts). Le chlorure d'aluminium complexe le chlorure d'acide et le transforme en excellent électrophile... -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Les amines aromatiques primaires, secondaires et tertiaires sont des dérivés de l'ammoniac dont un hydrogène au moins est remplacé par un reste aromatique. Le représentant le plus important de cette famille est l' aniline ou monoaminobenzène. -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
L' aniline est un composé organique renfermant une fonction amine primaire, c'est-à-dire un atome d'azote lié à un carbone et à deux hydrogènes ; l'atome de carbone appartenant à un noyau benzénique, il s'agit d'une amine aromatique, la plus simple de toutes. Elle a pour formule...
-
ANTHRACÈNE
- Écrit par Dina SURDIN
- 233 mots
Formule brute : C14H10
Masse moléculaire : 178,22 g
Masse spécifique : 1,25 g/cm3
Point de fusion : 217 0C
Point d'ébullition : 354-355 0C.
Cet hydrocarbure cyclique cristallise en prismes monocliniques incolores et présente une fluorescence violette quand il est absolument pur.
L'énergie...
- Afficher les 30 références
Voir aussi
- BUTADIÈNE
- ORBITALES ATOMIQUES
- DÉLOCALISATION ÉLECTRONIQUE
- SUBSTITUTION, chimie
- CYCLIQUES COMPOSÉS
- CHARGE ÉLECTRIQUE
- BORAZOLE
- FONCTION D'ONDE
- HYPSOCHROME EFFET
- HÜCKEL RÈGLE DE
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- ÉNERGIE DE CONJUGAISON ou ÉNERGIE DE RÉSONANCE, chimie
- ADDITION, chimie
- BATHOCHROME EFFET
- CRAIG RÈGLE DE
- AZULÈNE
- ÉNERGIE DE LIAISON
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉLECTRONIQUE STRUCTURE
- CONJUGAISON, chimie
- STABILITÉ, chimie
- SPECTRE D'ABSORPTION
- DENSITÉ ÉLECTRONIQUE