ANTIOXYGÈNES
Autoxydation
On désigne généralement par « autoxydation » une oxydation lente qui peut être effectuée par l'oxygène atmosphérique à des températures peu élevées, le plus souvent en phase liquide, par opposition aux processus rapides de combustion ou d'inflammation qui nécessitent des températures élevées. Ce terme ne s'applique pas au phénomène d'oxydation biologique (respiration) ni à l'oxydation des métaux (corrosion).
De nombreuses substances organiques naturelles ou synthétiques, exposées à l'air, s'autoxydent. Parmi les hydrocarbures, les alcènes sont attaqués plus facilement que les alcanes ; les substances contenant des groupes C—H tertiaires sont particulièrement sensibles à l'action de l'oxygène libre. Les éthers-oxydes et les aldéhydes sont également des composés autoxydables.
L'autoxydation provoque des modifications chimiques qui altèrent les propriétés de ces produits et les rendent impropres à l'utilisation normale. Le vieillissement des substances autoxydables a été reconnu depuis longtemps, mais la compréhension du phénomène est relativement récente.
Des études analytiques ont montré qu'au cours des réactions d'autoxydation, il se forme tout d'abord des peroxydes. Ceux-ci se décomposent ensuite en produits plus stables et conduisent à des mélanges souvent complexes.
Il convient de signaler que, dans certains cas, l'autoxydation est une réaction intéressante : c'est ainsi que l'autoxydation du cumène (ou isopropylbenzène) fournit un hydroperoxyde dont la décomposition est réalisée industriellement pour préparer le phénol et l'acétone.
Mécanisme
Du point de vue de la cinétique, la réaction d'autoxydation est caractérisée par l'existence d'une période d'induction au début de la réaction, au cours de laquelle la vitesse est pratiquement négligeable. La vitesse de la réaction croît ensuite rapidement puis se stabilise.
Ces faits s'accordent avec le mécanisme d'une réaction radicalaire en chaîne. Si l'on représente le composé autoxydable par la formule R—H, la liaison covalente entre l'hydrogène et le groupe R résulte de la mise en commun de deux électrons, l'un étant fourni par l'atome d'hydrogène et l'autre par un atome de carbone du groupe R.
La réaction de départ de la chaîne (appelée aussi réaction initiatrice) consiste en la scission homolytique de la liaison R — H avec formation de deux fragments (radicaux libres) comportant chacun un électron non couplé :
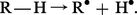
Cette réaction peut s'effectuer sous l'influence de divers facteurs qui seront précisés ultérieurement.
Dans un second temps, il y a propagation de la chaîne par suite des réactions suivantes :
Action de l'oxygène sur le radical R⦁ avec formation d'un radical peroxyde :
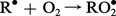
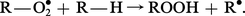
Il se forme un hydroperoxyde et il y a régénération du radical libre R⦁ qui peut à son tour amorcer une nouvelle chaîne et ainsi de suite.
La chaîne peut être interrompue par l'une des réactions de rupture suivantes :
– combinaison de deux radicaux R⦁ :
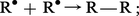
– combinaison de deux radicaux peroxydes avec libération d'oxygène :

– combinaison d'un radical R⦁ et d'un radical peroxyde :

Certains hydroperoxydes sont peu stables et se décomposent spontanément en produits oxygénés. Au cours de cette transformation, il y a création de radicaux libres qui provoquent l'amorçage de nouvelles chaînes (chaînes ramifiées) et accroissent ainsi la vitesse de l'autoxydation.
Catalyse
La scission homolytique de la liaison R—H d'un composé autoxydable peut être obtenue de diverses manières :
– par irradiation ultraviolette : l'absorption d'énergie lumineuse par la substance autoxydable[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert PANICO : docteur ès sciences, professeur à l'École supérieure de physique et de chimie industrielles de Paris
Classification
Pour citer cet article
Robert PANICO. ANTIOXYGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
...plastiques utilise les résines obtenues par condensation de l'aniline et du formol. L'industrie du caoutchouc emploie des dérivés de l'aniline, soit comme antioxygènes, destinés à préserver la gomme du vieillissement par oxydation : phényl-β-naphtylamine (d) obtenue par condensation avec le β-naphtol ; soit... -
ÉLASTOMÈRES ou CAOUTCHOUCS
- Écrit par Christian HUETZ DE LEMPS, Françoise KATZANEVAS
- 7 896 mots
- 9 médias
– Les agents de protection. Ils sont destinés à protéger l'élastomère, dont les chaînes macromoléculaires sont plus ou moins sensibles, contre l'oxygène et l'ozone principalement. Ces produits sont généralement des dérivés aminés ou phénoliques. -
HYDROQUINONE
- Écrit par Dina SURDIN
- 172 mots
Benzène-1,4-diol ou paradiphénol C6H4 (OH)2.
Masse moléculaire : 110,11 g
Masse spécifique : 1,358 g/cm3
Point de fusion : 170,5 0C
Point d'ébullition : 286,2 0C.
Composé dimorphe : cristallise en prismes hexagonaux incolores après recristallisation dans l'eau, ou en feuilles monocliniques....
-
OXYGÈNE
- Écrit par Robert CREUSE, René NOTO
- 6 248 mots
- 13 médias
Certains composés, dits antioxygènes (Moureu et Dufraisse), agissent comme des inhibiteurs, tel l'hydroquinone. On les utilise pour bloquer le vieillissement du caoutchouc, des graisses et, dans les moteurs à explosion, pour éviter le cognement.
Voir aussi