ANTIOXYGÈNES
Effet antioxygène
De nombreuses substances végétales, altérables à l'air de par leur constitution chimique, se trouvent protégées naturellement par la présence de petites quantités de certains composés reconnus maintenant comme étant des antioxygènes. C'est le cas, entre autres, de diverses huiles ou graisses végétales et du latex de caoutchouc.
La première démonstration expérimentale de l'effet antioxygène a été fournie par les travaux de C. Moureu et C. Dufraisse (1917) sur l'autoxydation des aldéhydes. L'aldéhyde benzoïque, composé autoxydable, peut être protégé de l'action de l'oxygène par addition d'une petite quantité d'une substance phénolique, par ailleurs oxydable, le pyrogallol.
De nombreuses études ont été effectuées depuis et ont permis d'établir que les antioxygènes agissent en tant que catalyseurs négatifs de l'autoxydation.
Les substances antioxygènes sont des accepteurs de radicaux libres qui réagissent avec ceux-ci dès leur formation en donnant des radicaux libres doués d'une faible réactivité :
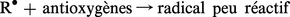
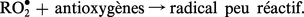
Un autre mode d'action est également possible : l'antioxygène (représenté par la formule A—H) peut céder un atome d'hydrogène au radical R⦁ (ou RO⦁2). Il se forme un nouveau radical libre peu réactif :

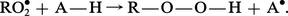
Les deux processus conduisent au même résultat : l'inhibition de la réaction par empêchement de la propagation de la chaîne, les radicaux libres résultants n'étant pas suffisamment réactifs pour attaquer une liaison C—H du composé autoxydable. Il en résulte une prolongation importante de la période d'induction : la substance autoxydable est stabilisée.
Du point de vue pratique, la période d'induction peut être considérée comme la durée de vie utile des substances autoxydables.
Une particularité à mettre en évidence est la parenté des catalyses inverses : un même catalyseur peut être capable de favoriser ou d'entraver la réaction d'autoxydation, selon la substance mise en œuvre. Ainsi, l'oxybromure de phosphore POBr3 constitue un antioxygène efficace pour l'aldéhyde benzoïque et un puissant accélérateur de l'autoxydation du styrène (il fonctionne alors comme « pro-oxygène »). Le choix d'un antioxygène, pour protéger un composé donné, nécessite donc une étude minutieuse.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Robert PANICO : docteur ès sciences, professeur à l'École supérieure de physique et de chimie industrielles de Paris
Classification
Pour citer cet article
Robert PANICO. ANTIOXYGÈNES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
...plastiques utilise les résines obtenues par condensation de l'aniline et du formol. L'industrie du caoutchouc emploie des dérivés de l'aniline, soit comme antioxygènes, destinés à préserver la gomme du vieillissement par oxydation : phényl-β-naphtylamine (d) obtenue par condensation avec le β-naphtol ; soit... -
ÉLASTOMÈRES ou CAOUTCHOUCS
- Écrit par Christian HUETZ DE LEMPS, Françoise KATZANEVAS
- 7 896 mots
- 9 médias
– Les agents de protection. Ils sont destinés à protéger l'élastomère, dont les chaînes macromoléculaires sont plus ou moins sensibles, contre l'oxygène et l'ozone principalement. Ces produits sont généralement des dérivés aminés ou phénoliques. -
HYDROQUINONE
- Écrit par Dina SURDIN
- 172 mots
Benzène-1,4-diol ou paradiphénol C6H4 (OH)2.
Masse moléculaire : 110,11 g
Masse spécifique : 1,358 g/cm3
Point de fusion : 170,5 0C
Point d'ébullition : 286,2 0C.
Composé dimorphe : cristallise en prismes hexagonaux incolores après recristallisation dans l'eau, ou en feuilles monocliniques....
-
OXYGÈNE
- Écrit par Robert CREUSE, René NOTO
- 6 248 mots
- 13 médias
Certains composés, dits antioxygènes (Moureu et Dufraisse), agissent comme des inhibiteurs, tel l'hydroquinone. On les utilise pour bloquer le vieillissement du caoutchouc, des graisses et, dans les moteurs à explosion, pour éviter le cognement.
Voir aussi