MÉTAUX Métaux de transition
Les cinquante-six éléments chimiques dits de transition actuellement connus comportent tous, soit à l'état d'élément simple, soit dans un état oxydé stable, une sous-couche électronique d ou f partiellement remplie. L'existence de niveaux profonds incomplets leur confère des propriétés voisines. À l'état de corps simples, ils se caractérisent par un haut point de fusion et une densité élevée. Ils présentent quelquefois des propriétés physiques anormales (ferromagnétisme, supraconductivité). Leur grande aptitude à former entre eux ou avec certains non-métaux (H, C, N, O) des alliages ou des solutions solides très résistants leur vaut un rôle primordial en métallurgie avancée (aciers spéciaux), en aéronautique (alliages au titane) et en physique nucléaire (piles). Fortement électropositifs, les éléments de transition, à l'exception des métaux nobles, se dissolvent généralement dans les acides minéraux. Leur oxydation conduit souvent à plusieurs degrés stables et dote les ions de propriétés paramagnétiques. L'existence simultanée de valences multiples explique leur tendance à la formation de phases non stœchiométriques, ainsi que les propriétés physiques particulières de certains composés et de quelques complexes, propriétés physiques largement utilisées par l'industrie (ferrites en informatique, grenats dopés pour l'émission laser par exemple). Les nombreuses applications des éléments de transition et de leurs dérivés en font ainsi des matériaux d'une importance économique essentielle : cela explique qu'ils ont été l'objet de nombreuses recherches.
Propriétés atomiques
Les éléments de transition se caractérisent par une participation des orbitales d à la liaison chimique. Cette définition englobe donc tous les atomes et les ions qui possèdent une sous-couche d incomplète : 3d du scandium au cuivre, 4d de l'yttrium à l'argent et 5d du lanthane à l'or. Le remplissage progressif des sous-couches 4f et 5f conduit aux séries des « éléments de transition interne » : les lanthanides (du cérium au lutétium) et les actinides (de l'actinium au lawrencium). On répertorie ainsi, sous l'expression d'éléments de transition, 56 des 117 éléments connus (au début de 2008) de la classification périodique.
L'évolution de leur cortège électronique se traduit par une variation du nombre d'électrons dans les couches profondes (n − 1)d ou (n − 2)f, la couche externe ne comportant au maximum que deux électrons ns, à l'exclusion de tout électron np. Il en résulte de grandes analogies entre tous ces éléments de transition.
La majeure partie de leurs propriétés s'explique à l'aide de la théorie du champ des ligands (ou « champ des coordinats »), qui considère la force des liaisons covalentes entre un atome (ou un ion) de transition A et un groupe de n ligands X en fonction de la symétrie du complexe AXn formé. La dégénérescence des cinq orbitales d de A est alors levée, les trois orbitales t2g (dxy, dyz et dzx) étant par exemple stabilisées en champ octaédrique (c'est l'inverse en champ tétraédrique) au détriment des deux orbitales eg (dx2 − y2 et dz2) d'une énergie Δc. Pour un atome (ou un ion) A donné, l'éclatement Δc dépend de la nature du ligand ; au sein de la série néphélauxétique, il augmente dans l'ordre :
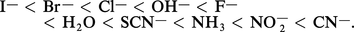
Pour un ligand donné, l'énergie Δc augmente par passage de la couche 3d à la couche 4d ; elle dépend en outre de la symétrie de l'édifice, puisque, par exemple, Δtétra = 4/9 (Δocta). L'énergie Δc augmente enfin avec la charge de l'ion.
En présence d'un champ magnétique H, chacun des deux niveaux t2g et eg éclate : un sous-niveau α peuplé d'électrons de spin + 1/2 (↑) est stabilisé d'une énergie d'échange[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André CASALOT : maître de conférences à l'université de Provence
Classification
Pour citer cet article
André CASALOT. MÉTAUX - Métaux de transition [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :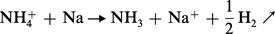
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








