MÉTAUX Métaux de transition
Propriétés physiques
Les éléments de transition et leurs composés présentent une température de fusion souvent très élevée (TF = 3 400 0C pour W), propriété qui les fait utiliser comme résistors de fours électriques et comme réfractaires (aciers spéciaux en aéronautique, gaines de protection). Ce sont en outre des matériaux particulièrement denses (d = 22,7 pour Os). Ils ont une dureté considérable (+ 9 de l'échelle de Mohs pour le carbure de tungstène).
À l'état d'éléments simples, ils constituent de bons conducteurs électroniques dont quelques-uns sont ferromagnétiques (Fe, Co) et d'autres supraconducteurs (V, Nb) à très basse température (réalisation de hauts champs magnétiques).
Si l'existence d'électrons f non appariés confère le plus souvent aux composés des lanthanides les propriétés des électrons localisés (paramagnétisme de Curie, isolant de bandes), la présence d'électrons d célibataires provoque chez les composés de transition des effets différents selon les cas : les électrons sont soit localisés, soit collectifs (paramagnétisme de Pauli, conduction métallique). Une transition isolant-métal peut même se produire lorsque s'élève la température (Tt = 340 K pour VO2). Au sein d'une série isostructurale, tout déplacement vers la droite renforce le caractère localisé des électrons par suite de la contraction des orbitales d du cation.
La coexistence, dans divers sites cristallographiques d'une structure donnée, d'ions de transition de nature et (ou) de charges différentes provoque la création de couplages ferro- et antiferromagnétiques entre les spins. Il en résulte parfois un moment non nul, ce qui offre un grand intérêt industriel (les ferrites servent de mémoires dans les ordinateurs). La conduction s'effectue souvent dans les oxydes par sauts d'électrons.
Dans leur degré d'oxydation maximal, les ions de transition favorisent la ferroélectricité. Douées d'une permittivité électrique élevée, de telles substances servent de base à l'industrie des condensateurs électriques et des céramiques.
Pour les lanthanides, l'existence de niveaux d'énergie discrets favorise l'apparition de transitions radiatives, sources de propriétés optiques utilisées dans de nombreuses applications (télévision en couleurs par exemple).
La radioactivité des actinides et de quelques isotopes (55Fe, 60Co) et ses applications sont enfin bien connues.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André CASALOT : maître de conférences à l'université de Provence
Classification
Pour citer cet article
André CASALOT. MÉTAUX - Métaux de transition [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :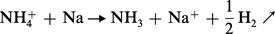
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








