ACIDO-BASIQUE ÉQUILIBRE
Les systèmes tampons
On appelle tampons des substances qui, lorsqu'elles sont présentes dans une solution, maintiennent celle-ci à un pH relativement constant, quand un acide ou une base y sont ajoutés.
Les systèmes tampons biologiques sont de deux types : extracellulaire et intracellulaire.
Systèmes extracellulaires
Les systèmes extracellulaires sont essentiellement plasmatiques (les phénomènes, quoique moins bien connus, semblent être du même ordre dans le tissu interstitiel) ; l'un est essentiel, c'est le système acide carbonique-bicarbonate, deux autres sont plus accessoires : système phosphate monosodique-phosphate disodique, et système protéine-protéinate.
Le système acide carbonique-bicarbonate
Le plasma contient, à l'état normal, 1,65 g/l de bicarbonate, et 0,085 g/l d'acide carbonique (correspondant à 0,060 g/l de gaz carbonique dissous). Il existe un équilibre, défini par l'équation :
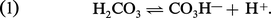
En fait, l'acide carbonique est très faiblement dissocié, et les ions CO3H- sont à peu près exclusivement ceux des bicarbonates. L'application de la loi d'action de masse à l'équation d'équilibre fournit :

L'équation (2) peut s'écrire :
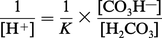
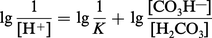

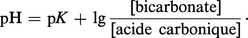
Le pK (correspondant à la constante de dissociation du premier hydrogène de l'acide carbonique) étant de 6,10, et le rapport bicarbonate/acide carbonique (mesuré dans des conditions physiologiques) de 20, le pH sanguin calculé est de 6,10 + lg 20 = 7,40, ce qui correspond bien aux valeurs mesurées expérimentalement pour le sang artériel.
Le système phosphate monosodique-phosphate disodique
Comme précédemment, on obtient, à partir de l'équation d'équilibre :
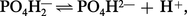
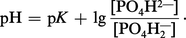
Le pK correspondant à la constante de dissociation du deuxième hydrogène de l'acide phosphorique est de 6,82 et le rapport :
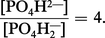
Ce système est théoriquement plus efficace que le système bicarbonate-acide carbonique, car le phosphate monosodique est un acide plus faible que l'acide carbonique ; en fait, il ne constitue biologiquement qu'un facteur accessoire, car il n'existe que peu de phosphates dans le plasma (2 milliéquivalents par litre).
Le système protéine-protéinate
Malgré sa faible efficacité théorique, le système protéine-protéinate joue un rôle non négligeable, en raison de l'importante concentration plasmatique en protéines (75 g/l), soit 18 mEq/l (milliéquivalents par litre).
Systèmes intracellulaires
Les systèmes intracellulaires sont de deux types : érythrocytaire (globules rouges) et extra-érythrocytaire.
Le système érythrocytaire
Le système érythrocytaire est constitué par l'ensemble hémoglobine- oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d'acides faibles. Cependant, la constante de dissociation de l'oxyhémoglobine est supérieure à celle de l'hémoglobine, ce qui revient à dire que l'oxyhémoglobine est un acide plus fort que l'hémoglobine ; elle libère donc des bases lors de sa transformation en hémoglobine dans les tissus. C'est justement à ce moment que le taux d'acide carbonique s'accroît à l'intérieur des érythrocytes ; les bases ainsi libérées donneront sur place des bicarbonates. L'accroissement d'acidité dû à l'augmentation d'acide carbonique est ainsi compensé non seulement par cette libération des bases, mais aussi par la diminution d'acidité due à la transformation de l'oxyhémoglobine en hémoglobine. Il existe donc, dans l'érythrocyte, deux systèmes tampons solidaires : hémoglobine-hémoglobinate, et surtout oxyhémoglobine-oxyhémoglobinate.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre KAMOUN : professeur de biochimie à l'université René-Descartes, chef de service à l'hôpital Necker, Paris
Classification
Pour citer cet article
Pierre KAMOUN. ACIDO-BASIQUE ÉQUILIBRE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
DIABÈTE
- Écrit par Éric RENARD
- 8 205 mots
- 5 médias
...moyen d'un appareil lecteur de glycémie (glucomètre). La situation décrite est une urgence métabolique qui doit conduire à l'apport immédiat d'insuline. Tout retard expose en effet au coma céto-acidosique. Celui-ci résulte d'une souffrance de l'organisme liée au développement d'une acidose par accumulation... -
KALIÉMIE
- Écrit par François BOURNÉRIAS
- 766 mots
Concentration du cation potassium (K+) dans le plasma, exprimée en milliéquivalent par litre (mEq/l). La mesure par photométrie de flamme est soumise à des causes d'erreurs nombreuses, la plus fréquente étant la lyse des hématies, riches en potassium, qui donne de fausses hyperkaliémies. Une...
-
MILIEU, écologie
- Écrit par Cesare F. SACCHI
- 7 829 mots
- 1 média
...dans l'eau et dans le sol. Il en est de même pour le potentiel d'oxydo-réduction (Eh), qui mesure en pratique le degré d'oxydation du milieu. Les organismes dits basophiles, comme plusieurs plantes (végétaux « calcicoles »), quelques animaux (mollusques terrestres, vers de terre, crustacés),... -
MILIEU INTÉRIEUR
- Écrit par Jean-Paul TRUCHOT
- 3 956 mots
- 4 médias
Lemilieu intérieur est le lieu de transit de nombreux déchets acides ou basiques du métabolisme cellulaire : dioxyde de carbone, acides minéraux et organiques. Les liquides extracellulaires de tous les animaux ont une réaction légèrement alcaline et leur acidification (ou leur alcalinisation) excessive... - Afficher les 8 références
Voir aussi
- CARBONIQUE ACIDE
- POUMON
- pK
- CONSTANTE DE DISSOCIATION
- HYPERCAPNIE
- ACIDOSE
- ANHYDRASE CARBONIQUE
- VAN SLYKE DONALD DEXTER (1883-1971)
- PLASMA SANGUIN
- ALCALOSE
- CHÉMORÉCEPTEUR
- PHYSIOLOGIE
- BICARBONATE DE POTASSIUM
- pH
- PHOSPHATES
- RÉGULATION BIOLOGIQUE
- OXYHÉMOGLOBINE
- BICARBONATE
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- AMMONIOGENÈSE
- HENDERSON-HASSELBACH ÉQUATION D'
- VENTILATION PULMONAIRE
- RÉABSORPTION, physiologie
- TUBULE RÉNAL
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE



