AMIDES
Préparations et modes de formation
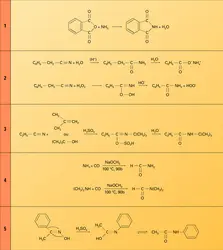
Les monoamides primaires se forment par déshydratation thermique des sels d'ammonium des acides carboxyliques. La distillation, à sec, de l'acétate d'ammonium donne quantitativement l' acétamide :

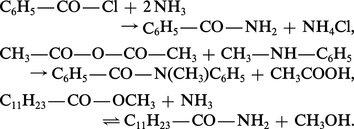
L' hydratation des nitriles, en catalyse acide ou basique, conduit aux amides primaires, mais la réaction est difficile à contrôler car ces derniers, dans ces conditions, s'hydrolysent en sel d'ammonium de l'acide. On peut toutefois contrôler cette hydratation en employant l'eau oxygénée qui forme un hydroperoxyde qui se décompose en amide en milieu basique. C'est la réaction de Radziszewski (réaction 2). L'addition à un nitrile des éléments d'un alcool, par condensation de celui-ci ou d'une oléfine en milieu H2SO4 concentré, conduit à un amide secondaire. C'est la réaction de Ritter (réaction 3).
Le formamide est fabriqué industriellement par carbonylation de l'ammoniac en présence de méthylate de sodium ; le diméthylformamide (DMF), solvant aprotique dissociant, est fabriqué d'une manière analogue (réaction 4).
La transposition des cétoximes, sous l'action d'un catalyseur acide, conduit aux amides secondaires (transposition de Beckmann). C'est le groupe situé en anti de la fonction oxime qui migre du carbone sur l'azote. C'est ainsi que l'acétophénone est transformée en acétanilide (réaction 5) et la cyclohexanone en caprolactame, monomère qui, par chauffage, se polymérise en un polyamide appelé Nylon 6. Il en est de même de l'oxime de la cyclododécanone qui donne le lauryllactame, monomère du nylon 12 (réaction 6).
On obtient un amide primaire par action de l'amidure de sodium sur une cétone non énolisable (réaction 7).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Formation d'un amide. Le nucléophile est l'ammoniac ou encore une amine primaire ou secondaire. On chauffe le sel d'ammonium ou d'aminium qui se déshydrate en amide. En fait, le sel est en équilibre avec l'acide et l'ammoniac, et c'est la réaction entre ces deux partenaires qui conduit, par une... -
NITRILES
- Écrit par Jacques METZGER
- 1 793 mots
- 1 média
Voir aussi