AMIDES
Propriétés physiques
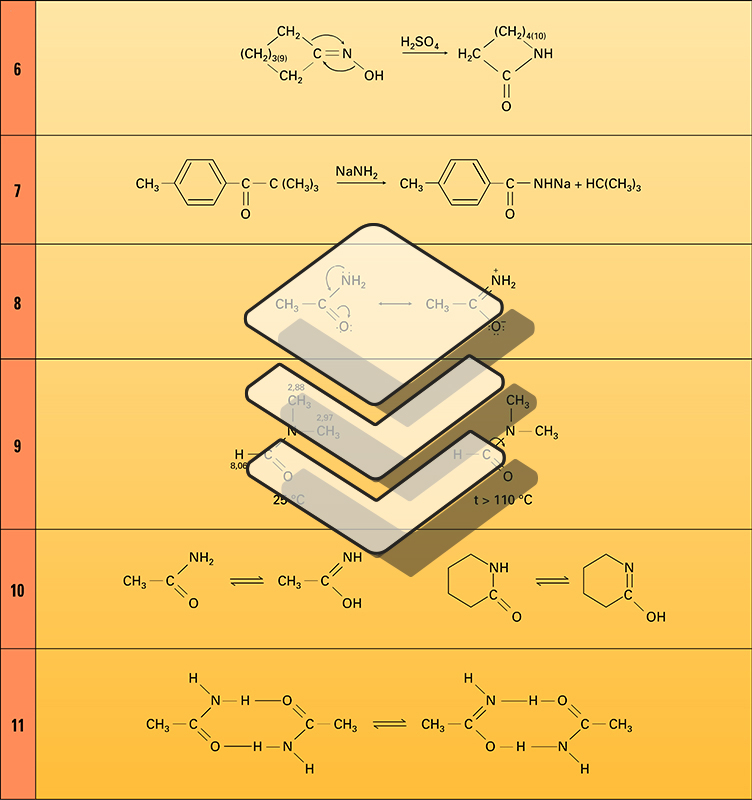
La structure électronique de la fonction amide est caractérisée par une conjugaison importante entre le doublet non partagé de l'azote et l'orbitale π du groupe carbonyle (formule 8). L' énergie de résonance de l'acétamide est de 46 kJ/mole, ce qui implique que, à température ordinaire, le groupe fonctionnel amide est plan et que la rotation autour de la liaison C−N est empêchée. On constate en effet que le spectre de résonance magnétique nucléaire (R.M.N.) protonique du diméthylformamide présente, à température ordinaire, deux signaux méthyle (2,88 et 2,97 ppm) se rapportant aux deux groupes CH3 situés dans un environnement différent. À température plus élevée (111 0C), ces deux signaux se regroupent en un seul signal plus large qui correspond à deux groupes CH3 situés dans le même environnement : à cette température, la rotation de la liaison C−N devient libre et les deux méthyles sont équivalents (formule 9).
Les amides primaires et secondaires existent sous deux formes isomères en équilibre, l'espèce « imino-alcool » étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l'état de dimères (formule 11), mais également sous la forme de polymères (formule 12). Cette association est responsable de la faible volatilité de ces amides : leurs températures d'ébullition sont anormalement élevées et supérieures à celles des acides. Elle joue un rôle essentiel dans la structure des protéines qui sont des polyamides secondaires, ainsi que dans la constitution des chaînes des acides désoxyribonucléiques (ADN) et leur assemblage spécifique en double hélice.
Le spectre infrarouge des amides est caractérisé par une intense absorption vers 1690-1630 cm-1 due à la vibration d'élongation C=O ; les amides primaires présentent deux bandes d'intensité moyenne dans la région 3 500-3 400 cm-1 correspondant aux liaisons NH libres et une bande large à 3 300-3 100 cm-1 se rapportant aux liaisons NH associées ; les secondaires n'ont plus que deux bandes : NH libre vers 3 400 cm-1 et NH associée vers 3 200 cm-1.
En raison de leur polarité, certains amides secondaires et tertiaires sont d'excellents solvants des composés polaires et non polaires (formules 13).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Formation d'un amide. Le nucléophile est l'ammoniac ou encore une amine primaire ou secondaire. On chauffe le sel d'ammonium ou d'aminium qui se déshydrate en amide. En fait, le sel est en équilibre avec l'acide et l'ammoniac, et c'est la réaction entre ces deux partenaires qui conduit, par une... -
NITRILES
- Écrit par Jacques METZGER
- 1 793 mots
- 1 média
Voir aussi