AMIDES
Propriétés chimiques
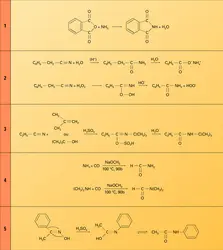
Les monoamides primaires et secondaires sont des acides très faibles dont le pKa est de l'ordre de 16. Les imides manifestent une acidité un peu plus importante. Ce sont également des bases très faibles dont l'acide conjugué présente un pKa de 0 (réaction 14).
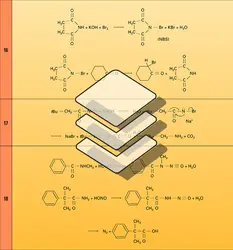
Obtenu par action de l'amidure de sodium, le sel de sodium d'un amide primaire s'alkyle normalement à l'azote ; le sel d'argent à l'oxygène (réaction 15). Dans les deux cas, le nucléophile acylamidure est le même, et sa réactivité est ambidente ; l'attaque de l'halogénure d'alkyle est bimoléculaire (SN2) dans le cas du sel de sodium, unimoléculaire (SN1) dans celui du sel d'argent.
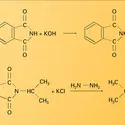
Les amides primaires et secondaires réagissent avec les halogènes en formant des dérivés halogénés à l'azote. Dans les dérivés bromés obtenus, le brome est positif. Cette propriété est mise à profit dans le cas des imides N-bromés, qui sont des réactifs de bromation soit ioniques, soit radicalaires. Le N-bromosuccinimide (NBS) est couramment employé à cet usage et le succinimide régénéré dans la réaction peut être recyclé par bromation (réaction 16).
Les amides primaires monobromés sont transformés, par la soude concentrée, en isocyanates dont l' hydrolyse conduit aux amines primaires ( dégradation des amides selon Hofmann) [réaction 17].
L'acide nitreux transforme les amides secondaires en nitrosamides stables. Dans le cas des dérivés primaires, l'intermédiaire nitrosé évolue vers un acyldiazonium dont l'hydrolyse conduit à un acide (réaction 18). Cette réaction est utilisée lorsque l'hydrolyse acide de l'amide est rendue difficile par encombrement stérique.
L' hydrogénation des amides peut être réalisée au moyen de l'hydrure complexe LiAlH4 (NaBH4 ne réduit pas) : on obtient les amines primaires, secondaires et tertiaires de même squelette (réactions 19). La réduction par le sodium et l'alcool (réaction de Bouveault et Blanc) conduit à un mélange d'alcool et d' amine.
Sous l'action d'agents déshydratants comme le pentoxyde ou le pentachlorure de phosphore (P4O10, P2Cl10), les amides primaires sont déshydratés en nitriles.
L'hydrolyse des amides, sans catalyseur, est très lente ; par contre, elle est fortement accélérée par les acides forts et les bases. Dans le premier cas, on obtient l'acide et le sel d'ammonium de l'acide fort ; dans le second, on arrive au sel minéral de l'acide avec libération d'ammoniac ou d'amine. De même, leur alcoolyse est lente et limitée.
L'action des organomagnésiens ne présente d'intérêt que dans le cas des amides tertiaires qui n'ont pas d'hydrogène acide. Le diéthylformamide réagit avec les organomagnésiens en formant un aldéhyde :
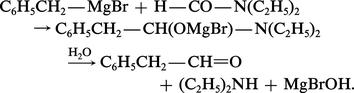
L'action du phosgène sur un amide tertiaire conduit à un chlorure d'imidinium particulièrement réactif et qui est utilisé en synthèse. Il en est de même de l'acétal d'amide qui résulte de l'action d'un alcoolate alcalin sur ce chlorure d'imidinium (réaction 20).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. AMIDES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTAMIDE (éthanamide)
- Écrit par Dina SURDIN
- 328 mots
CH3—CO—NH2
Masse moléculaire : 59,07 g
Masse spécifique : 1,16 g/cm3
Point de fusion : 82 0C
Point d'ébullition : 222 0C.
Monoamide primaire se présentant en cristaux blancs hexagonaux ou rhomboédriques. La structure cristalline de l'acétamide déterminée par les rayons X (méthode du...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Formation d'un amide. Le nucléophile est l'ammoniac ou encore une amine primaire ou secondaire. On chauffe le sel d'ammonium ou d'aminium qui se déshydrate en amide. En fait, le sel est en équilibre avec l'acide et l'ammoniac, et c'est la réaction entre ces deux partenaires qui conduit, par une... -
NITRILES
- Écrit par Jacques METZGER
- 1 793 mots
- 1 média
Voir aussi