ALDÉHYDES ET CÉTONES
Préparations et modes de formation
Les préparations et modes de formation des dérivés carbonylés sont très nombreux et disparates ; les aldéhydes sont cependant d'un accès plus délicat que les cétones.
La fonction simple divalente carbonyle peut être formée par oxydation d'hydrocarbures ou de fonctions simples monovalentes, notamment d'alcools, par hydrolyse de fonctions simples divalentes (notamment de dihalogénés géminés) et par réduction de fonctions simples trivalentes (en particulier d'acides carboxyliques). Elle peut également résulter de la dégradation de fonctions mixtes. Elle peut enfin être introduite sur une chaîne hydrocarbonée au moyen de monoxyde de carbone.
Méthodes d'oxydation
Hydrocarbures
Certains hydrocarbures arylaliphatiques sont oxydés en dérivés carbonylés : les aldéhydes aromatiques peuvent être préparés au laboratoire par oxydation de groupes méthyle portés par le cycle, au moyen de chlorure de chromyle (méthode d'Étard).
Les oléfines simples, telles que l'éthylène et le propène, sont oxydées par les sels de palladium en milieu chlorhydrique concentré, respectivement en acétaldéhyde et acétone. Le procédé industriel (Wacker-Hoechst) introduit de l'oxygène pour réoxyder le palladium qui, de ce fait, joue le rôle d'un catalyseur.
La cyclohexanone, intermédiaire important de la fabrication des nylons 6 et 6-6, est obtenue par oxydation à l'air du cyclohexane en présence de sels de manganèse ou de cobalt. La cyclododécanone, intermédiaire de la confection du nylon 12, est préparée d'une manière semblable à partir du cyclododécane.
Alcools
La déshydrogénation d'un alcool primaire donne un aldéhyde.
L'oxydation des alcools secondaires par les mêmes réactifs ne pose pas le même problème, la cétone formée résistant au milieu oxydant.
Méthodes de réduction
Les principales méthodes de préparation des dérivés carbonylés mettant en œuvre la réduction du substrat concernent les acides et les fonctions dérivées.
Aldéhydes
Les chlorures d'acides sont hydrogénés en aldéhydes par des hydrures métalliques complexes encombrés comme l'hydrure de tritertiobutoxyaluminiumlithium ; la réaction s'arrête au stade aldéhyde pour des raisons d'encombrement stérique. Une autre méthode très générale, appelée la réaction de Rosenmund, consiste à hydrogéner le chlorure d'acide par l'hydrogène, en présence d'un catalyseur spécifique : le palladium empoisonné par la quinoléine-soufre, ou le palladium sur charbon, en présence d'éthyldiisopropylamine, qui absorbe HCl formé.
Les acides eux-mêmes sont plus difficiles à réduire, et il est rare, une fois l'opération commencée, de ne pas aller jusqu'à l'alcool primaire.
Les esters, les amides et les nitriles sont hydrogénés en aldéhydes au moyen d'un hydrure complexe encombré, l'hydrure de diisobutylaluminium ou l'hydrure de tritertiobutoxyaluminiumlithium. La réaction est réalisée à basse température et le produit obtenu est hydrolysé.
La réduction des nitriles par le chlorure stanneux en milieu chlorhydrique anhydre (réaction de Stephen) s'arrête au stade de l'imine, qui est salifiée par l'acide ; il suffit d'hydrolyser pour obtenir l'aldéhyde.
Cétones
Les méthodes de préparation des cétones au départ des acides, ou de fonctions dérivées, mettent en œuvre des réducteurs au sens large (organométalliques, aromatiques).
L' acylation des aromatiques par les chlorures d'acides en présence de chlorure d'aluminium est l'une des façons les plus générales d'obtenir des arylcétones ( réactions d'acylation de Friedel et Crafts). Le chlorure d'aluminium complexe le chlorure d'acide et le transforme en excellent électrophile ; le substrat aromatique joue le rôle de nucléophile (réducteur) et forme l'arylalkylcétone,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
La réduction des aldéhydes et des cétones en alcools primaires et secondaires peut être réalisée par l'action de l'hydrogène en présence de catalyseur métallique comme le platine Pt et le nickel Ni :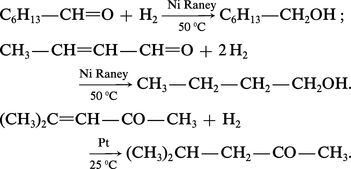
-
ALDOLS & CÉTOLS
- Écrit par Jacques METZGER
- 1 406 mots
- 3 médias
Aldols et cétols sont les composés dont la chaîne hydrocarbonée porte à la fois une fonction alcool et une fonction carbonyle, aldéhyde ou cétone.
C'est Charles Adolphe Wurtz qui a donné le nom d'aldol (de aldéhyde-alcool) au composé résultant de la dimérisation de l'acétaldéhyde...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Addition sur les aldéhydes et les cétones : les amines primaires forment un hémiaminal qui se déshydrate facilement en donnant une aldimine ou une cétimine. Les amines secondaires forment également un hémiaminal dont la déshydratation conduit à une énamine, l'élimination de l'eau se faisant par entraînement... - Afficher les 8 références








