CYCLOHEXANE
Cyclane de formule :
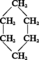
Masse moléculaire : 84,16 g
Masse spécifique : 0,7791 g/cm3 à 20 0C
Température de fusion : 6,5 0C
Température d'ébullition : 81,4 0C
C'est un liquide incolore, mobile, d'odeur relativement agréable, insoluble dans l'eau, soluble dans les solvants organiques, notamment l'éthanol et l'éther avec lesquels il est complètement miscible. La formule plane ci-dessus ne représente pas correctement le cyclohexane dans la mesure où, du fait des angles que font entre elles les liaisons des atomes de carbone, la molécule prend dans l'espace une forme non plane « chaise » (la plus stable) ou « bateau ».
En tant qu'hydrocarbure saturé cyclique (cyclane), le cyclohexane est chimiquement assez inerte ; il réagit en fait essentiellement comme une paraffine, à cela près que tous les atomes de carbone y occupent des positions équivalentes. En ce qui concerne l'utilisation, la seule réaction digne de mention pour le cyclohexane est celle qui lui vaut une existence industrielle notable (de l'ordre du million de tonnes par an, aux États-Unis par exemple), c'est-à-dire son oxydation en mélange de cyclohexanol C6H11OH et de cyclohexanone C6H10O qui, par l'intermédiaire de celle-ci, permet d'aboutir aux matières premières des principaux nylons : le Nylon-6,6 à partir d'acide adipique HOOC—(CH2)4—COOH et d'hexaméthylène diamine H2N—(CH2)6—NH2 et le Nylon-6 via le caprolactame

Accessoirement, une petite proportion du cyclohexane est utilisée comme solvant.
Les nylons ont été développés industriellement lors de la Seconde Guerre mondiale et de l'immédiat après-guerre ; c'est donc de cette époque que date l'essor de la production du cyclohexane. Il est obtenu presque uniquement par hydrogénation du benzène, dont il constitue, dans les pays industrialisés le deuxième ou le troisième débouché par ordre d'importance ; il a alors une pureté avoisinant 99,9 p. 100.

Un petit complément de production vient de la distillation de fractions pétrolières et de l'isomérisation simultanée du méthylcyclopentane.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Fernand COUSSEMANT : ancien directeur de l'École nationale supérieure de chimie de Paris
Classification
Pour citer cet article
Fernand COUSSEMANT. CYCLOHEXANE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Autres références
-
BARTON DEREK HAROLD RICHARD (1918-1998)
- Écrit par Georges BRAM
- 484 mots
- 1 média
Chimiste britannique né à Gravesend (Kent). Derek Harold Richard Barton obtient son doctorat en 1942 à l'Imperial College de l'université de Londres, où il travaille deux ans dans un laboratoire dépendant des autorités militaires. Après un an passé dans l'industrie chimique, il retourne à l'Imperial...
-
CONFORMATIONS, chimie
- Écrit par Jacques GORÉ
- 3 324 mots
- 5 médias
Lessystèmes cyclohexaniques sont de très loin les plus importants : un grand nombre de produits naturels (stéroïdes, terpénoïdes, alcaloïdes) contiennent, dans leur molécule, au moins un noyau à six atomes de carbone. C'est Sachse qui, le premier, a supposé l'existence d'un cycle non plan pour le cyclohexane... -
CYCLANES & CYCLÈNES
- Écrit par Jean-Marie CONIA
- 1 907 mots
- 7 médias
...des différents cyclanes. On constate, par exemple, que la chaleur de combustion par unité CH2, qui est de 658 kJ pour les alcanes, est la même pour le cyclohexane, parce que ce dernier est sans tension sous la forme chaise qu'il adopte préférentiellement ; elle est légèrement plus grande pour le cyclopentane... -
HASSEL ODD (1897-1981)
- Écrit par Georges BRAM
- 403 mots
Chimiste norvégien né et mort à Oslo. Après ses études à l'université d'Oslo, Odd Hassel va à l'Institut Kaiser-Wilhem de Berlin s'initier à la cristallographie par diffraction des rayons X. Il y soutient son doctorat en 1924 et bénéficie ensuite, pendant un an, d'une bourse Rockefeller obtenue...
- Afficher les 7 références


