ALDÉHYDES ET CÉTONES
Structure et propriétés physiques
La structure électronique de la fonction carbonyle dans le modèle orbitalaire est définie par le partage par les atomes de carbone sp2 et d'oxygène sp2, de deux doublets d'électrons décrits respectivement par deux orbitales moléculaires, l'une de symétrie σ, résultant du recouvrement (longitudinal) des orbitales hybrides sp2 des deux atomes (liaison σ) et l'autre de symétrie π, résultant du recouvrement (latéral) de leurs fonctions pz (liaison π). Le plan nodal (ou d'antisymétrie) de la fonction d'onde moléculaire π contient les noyaux des deux atomes C et O et des deux autres qui sont liés au carbone (un C sp3 et un H pour les aldéhydes, deux C sp3 pour les cétones), ainsi que les axes de symétrie des deux orbitales hybrides sp2 qui décrivent les deux doublets non partagés de l'oxygène. Cette structure électronique, qualitativement comparable à celle de la liaison π éthylénique, impose que les quatre noyaux atomiques soient coplanaires et que le squelette des liaisons σ qui les unit soit rigide. Mais, à la différence de la distribution symétrique de la densité électronique π de l'éthylène, celle du méthanal est rendue dissymétrique par la différence d'électronégativité des deux partenaires C et O. Ainsi, dans l'orbitale π liante, la densité du doublet de liaison est fortement déportée vers le noyau d'oxygène, tandis que, dans l'orbitale π* antiliante (qui interviendra dans les additions nucléophiles), c'est la fonction pz du carbone qui apporte la contribution la plus importante. Une conséquence directe de cette structure est l'existence d'une polarisation de la liaison double carbonyle, dans le sens de charges nettes négatives au niveau de l'oxygène et positives au niveau du carbone. Les dérivés carbonylés possèdent en effet un moment électrique permanent dipolaire relativement important : 2,3 D pour le méthanal, 2,5 D pour l'éthanal et 2,9 D pour l'acétone.
Aldéhydes et cétones sont des molécules associées, à l'état liquide, par des interactions entre dipôles : cette association est moins importante que celle des alcools, par suite de l'absence de liaisons hydrogène. Il en résulte qu'ils sont, pour les premiers termes principalement, plus volatils que les alcools correspondants, mais nettement moins que les alcanes de même poids moléculaire. Tous cristallisent assez difficilement ; en dehors de quelques dérivés aromatiques, ils sont liquides à la température ordinaire.
La polarité de la fonction assure la formation de liaisons hydrogène avec les solvants protiques, notamment avec l'eau, dans laquelle les premiers termes sont solubles. Il faut noter toutefois que le méthanal, en solution dans l'eau (formol), s'y trouve entièrement hydraté, tandis que l'éthanal ne l'est que d'une manière partielle et réversible, et l'acétone pratiquement pas.
Les dérivés carbonylés sont en général miscibles aux liquides organiques usuels (éther, alcool, chloroforme, toluène, acide acétique). Seules l'acétone et la méthyléthylcétone sont des solvants d'usage courant.
L'odeur varie avec la nature du squelette carboné. Le méthanal est suffocant, l'éthanal également ; l'acétone a une odeur caractéristique ; les aldéhydes linéaires moyens provoquent la nausée ; les aldéhydes α-éthyléniques, d'abord lacrymogènes et suffocants (acroléine, crotonaldéhyde), deviennent ensuite odorants, surtout s'ils sont ramifiés. L'aldéhyde benzoïque a l'odeur des amandes amères, et l'acétophénone également, cependant plus atténuée. C'est dans l'ensemble des aldéhydes et des cétones ramifiées, se rattachant en particulier à la série terpénique, ainsi que dans les aldéhydes et cétones aromatiques à chaîne latérale ramifiée, que l'on trouve le plus grand nombre de [...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ALDÉHYDES ET CÉTONES [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
ACÉTALS
- Écrit par Jacques METZGER
- 866 mots
- 1 média
Les acétals sont les composés gem-dialcoxylés c'est-à-dire qui portent sur le même atome de carbone tétracoordiné de la chaîne deux fonction éther-oxyde. Ils dérivent formellement de l'élimination d'une molécule d'eau entre un dérivé carbonylé et deux molécules d'alcool (réaction 1). On distingue...
-
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
La réduction des aldéhydes et des cétones en alcools primaires et secondaires peut être réalisée par l'action de l'hydrogène en présence de catalyseur métallique comme le platine Pt et le nickel Ni :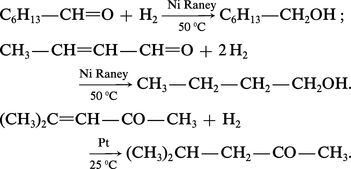
-
ALDOLS & CÉTOLS
- Écrit par Jacques METZGER
- 1 406 mots
- 3 médias
Aldols et cétols sont les composés dont la chaîne hydrocarbonée porte à la fois une fonction alcool et une fonction carbonyle, aldéhyde ou cétone.
C'est Charles Adolphe Wurtz qui a donné le nom d'aldol (de aldéhyde-alcool) au composé résultant de la dimérisation de l'acétaldéhyde...
-
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Addition sur les aldéhydes et les cétones : les amines primaires forment un hémiaminal qui se déshydrate facilement en donnant une aldimine ou une cétimine. Les amines secondaires forment également un hémiaminal dont la déshydratation conduit à une énamine, l'élimination de l'eau se faisant par entraînement... - Afficher les 8 références








