ACIDIFICATION DES OCÉANS
- 1. L'océan, un régulateur de la teneur en dioxyde de carbone de l'atmosphère
- 2. La chimie de l'océan et le dioxyde de carbone
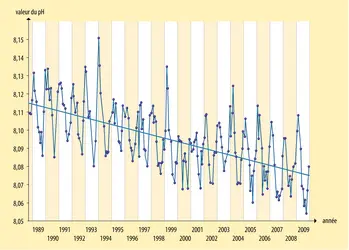
- 3. Mesure de la décroissance du pH de l'océan
- 4. Baisse du pH et perturbation des carbonates
- 5. Quels sont les impacts pour les écosystèmes marins ?
- 6. Bibliographie
- 7. Sites internet
La chimie de l'océan et le dioxyde de carbone
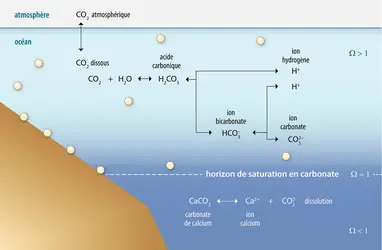
À la différence d'autres gaz comme le di-oxygène (O2), le CO2 non seulement se dissout dans l'eau mais réagit avec elle pour former de l'acide carbonique (H2CO3) qui, lui-même, se dissocie en ions bicarbonates (HCO3–) et en ions carbonates (CO32–) (fig. 1). En libérant des ions H+, ces réactions vont accroître la concentration de ces ions dans l'eau, d'où une augmentation de l'acidité, ce qui se traduit par une baisse du pH. Dans l'océan actuel, avec un pH de 8,1, la concentration en bicarbonates domine largement celle des carbonates et celle du CO2 libre dissous. Dans ces conditions, les ions calcium (Ca2+) de l'eau de mer réagissent avec les bicarbonates pour former du carbonate de calcium (CaCO3) ou calcaire. Ce composé peut précipiter (devenir solide) dans l'eau de mer ou s'accumuler dans certains organismes, dits « organismes calcaires », leur permettant de constituer leur coquille, ou leur test (exosquelette). Ces structures peuvent être composées de calcite (par exemple chez les coccolithophoridés [algues unicellulaires] et les foraminifères planctoniques), ou d' aragonite (ptéropodes [escargots planctoniques], coraux, mollusques tels que les huîtres), les deux formes cristallines principales du carbonate de calcium. Certains autres mollusques, comme les ormeaux, sécrètent des coquilles composées de couches alternées de calcite et d'aragonite. Du carbonate de magnésium peut aussi se former de façon analogue chez plusieurs crustacés et chez certaines algues.
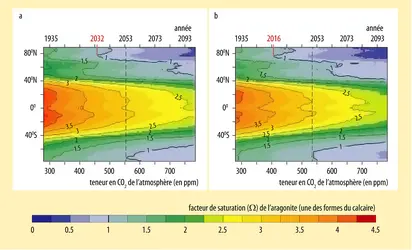
La solubilité du carbonate de calcium dépend de la température, de la pression et de la salinité de l'eau. Pour l'exprimer, on définit le facteur de saturation Ω. Lorsqu'il est supérieur à 1, le carbonate de calcium précipite ; lorsqu'il est inférieur à 1, il se dissout. L'horizon de saturation (Ω = 1) se situe en général en profondeur (fig. 1). Le carbonate de calcium peut donc exister sous forme solide de la surface de l'océan jusqu'à la profondeur à laquelle se situe l'horizon de saturation. En revanche, dans l'océan profond trop « acide », il se dissout.
Quand la teneur en CO2 de l'eau de mer augmente, on pourrait penser que l'on favorise la formation du carbonate de calcium. En fait, l'excès de CO2 réagit avec ce composé pour former des ions bicarbonates et calcium. Donc, on déstabilise le carbonate de calcium.
La formation de carbonate de calcium dans les organismes calcaires marins ne se résume toutefois pas à une précipitation purement chimique. Elle implique des mécanismes biochimiques complexes qui ne sont pas ici présentés.
- 1. L'océan, un régulateur de la teneur en dioxyde de carbone de l'atmosphère
- 2. La chimie de l'océan et le dioxyde de carbone
- 3. Mesure de la décroissance du pH de l'océan
- 4. Baisse du pH et perturbation des carbonates
- 5. Quels sont les impacts pour les écosystèmes marins ?
- 6. Bibliographie
- 7. Sites internet
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul TRÉGUER : professeur émérite à l'université de Brest
Classification
Pour citer cet article
Paul TRÉGUER. ACIDIFICATION DES OCÉANS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
OCÉANOGRAPHIE
- Écrit par Patrick GEISTDOERFER
- 10 052 mots
- 11 médias
...partie) responsable, avec les autres gaz à effet de serre (comme le méthane), du changement climatique de notre planète. Ce déséquilibre entraîne une acidification de l’eau de mer (diminution du pH) dont les conséquences sont néfastes pour les récifs coralliens et pour certains organismes à la coque... -
PLANCTON
- Écrit par Stéphane GASPARINI
- 3 265 mots
- 9 médias
...boucle microbienne peu favorable aux espèces exploitées. Une autre conséquence de l'augmentation du niveau de dioxyde de carbone dans l'atmosphère est une diminution progressive du pH des océans : on parle d'acidification des océans. Ce phénomène menace l'équilibre des carbonates, lequel est... -
RÉCIFS CORALLIENS
- Écrit par Pascale JOANNOT
- 6 438 mots
...d'augmenter dans l'atmosphère, sa dissolution croissante dans l'eau de mer entraînera une augmentation de l'acide carbonique (H2CO3), ce qui provoquera une acidification de l'eau de mer. En effet, l'eau, en se combinant avec le CO2, forme de l'acide carbonique qui a la particularité de dissoudre...
Voir aussi
- CARBONIQUE ACIDE
- OCÉANOGRAPHIE ET OCÉANOLOGIE
- CARBONATE ION
- SOLUBILITÉ
- CALCITE
- ARAGONITE
- pH
- EAU DE MER
- BICARBONATE
- MOULE, zoologie
- MARINE BIOLOGIE
- GAZ À EFFET DE SERRE
- CORAIL
- COQUILLE
- ANTHROPISATION
- HUÎTRE
- EXOSQUELETTE
- TEST, zoologie
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE
- CARBONATE DE CALCIUM
- EPOCA (European Project on Ocean Acidification)