ARSENIC
L'arsenic est l'élément chimique de symbole As et de numéro atomique 33. Bien qu'il soit très répandu dans le règne minéral et dans les organismes vivants, une quarantaine d'éléments sur quatre-vingt-douze sont plus abondants que lui ; il ne représente qu'environ cinq millionièmes en masse de la croûte terrestre. Son importance vient de son rôle physiologique ; c'est un constituant systématique de la cellule vivante, où il sert de biocatalyseur. De nombreux composés de l'arsenic sont fortement toxiques, les composés minéraux l'étant plus que les composés organiques. Néanmoins, la pharmacologie utilise de nombreux produits arsenicaux.
L'arsenic natif est rare ; à l'état naturel il existe principalement sous forme de minéraux sulfurés : le réalgar As4S4, l' orpiment As4S6 et surtout le mispickel dont la composition répond sensiblement à la formule FeAsS alors qu'il s'agit en réalité d'un mélange d'arséniure de fer FeAs2 et de pyrite FeS2 de mêmes structures cristallines ; la pyrite arsenicale FeAs2 existe également dans la nature ; à ces sulfures s'ajoutent deux oxydes, l'arsénolite et la claudétite, et de nombreux arséniates métalliques. La sublimation facile de l'arsenic élémentaire facilite sa préparation.
La belle couleur jaune d'or de l'orpiment avait attiré l'attention des Anciens : Aristote le connaissait et Pline l'appela auri pigmentum. Les alchimistes savaient griller les sulfures pour préparer l'« arsenic blanc » ou anhydride arsénieux, et il semble que l'arsenic élémentaire ait été isolé dès le xiiie siècle, mais cela reste incertain jusqu'au xviiie siècle. L'importance de l'arsenic est considérable pour les alchimistes à cause de ses relations avec le roi des métaux : l'or ; en plus de la couleur du sulfure, on savait, en effet, que l'arsenic ajouté à du cuivre donne un métal blanc qu'on assimilait à l'argent ; un pas était donc franchi d'un métal vil vers un métal noble ; il ne restait plus alors qu'à « transmuter » l'argent en or.
Propriétés
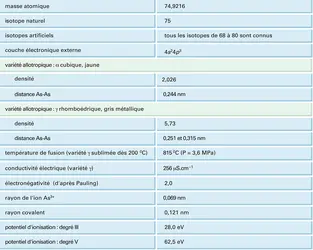
Au sein de la classification périodique des éléments, l'arsenic se situe au milieu de la cinquième colonne : il succède à l'azote et au phosphore typiquement non métalliques dont les degrés d'oxydation fondamentaux sont − III, + III et + V ; il précède l' antimoine et le bismuth chez lesquels le caractère métallique s'accentue avec prépondérance presque exclusive du degré d'oxydation + III. L'arsenic est un élément intermédiaire qui se rattache tantôt à un groupe, tantôt à l'autre. Comme l'azote et le phosphore, l'arsenic possède un hydrure AsH3, assez stable, qui est à l'origine d'une importante famille de dérivés organiques. Le phosphore et l'arsenic ont des électronégativités très voisines. Pour ces deux éléments, les composés oxygénés pentavalents sont les plus stables. L'arsenic se rapproche de l'antimoine et du bismuth par sa structure cristalline et par le fait que la variété stable conduit la chaleur et l'électricité. Son caractère métallique apparaît aussi dans les arséniures métalliques, qui ont souvent les propriétés d'un alliage.
Cortège électronique, modes de liaison
Le cortège électronique de l'arsenic se compose de deux électrons K, huit électrons L et dix-huit électrons M, qui constituent le cœur chimiquement inerte de l'atome. La couche de valence possède cinq électrons, répartis en un doublet 4s et trois électrons non appariés, chacun sur une orbitale 4p (cf. tableau).
Ce cortège électronique offre plusieurs possibilités théoriques de liaison avec d'autres atomes, ce qui implique des propriétés structurales différentes. Il faut remarquer que, même[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. ARSENIC [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ARSENIC, toxicologie
- Écrit par Universalis
- 255 mots
L'arsenic entrait autrefois dans la composition de nombreux produits insecticides, raticides, pesticides comme de certaines peintures, papiers peints et céramiques.
L'empoisonnement arsenical chez l'homme résulte souvent de l'ingestion ou de l'inhalation d'un insecticide contenant oxyde arsénieux,...
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
...essentiellement par des dérivés organiques, tandis que les composés + III sont les plus nombreux et que la stabilité du degré + V est plus faible que chez l'arsenic. Par l'ensemble de ses propriétés, l'antimoine est très proche de l'arsenic, avec un caractère métallique plus accentué. Le potentiel électrochimique de... -
LÖLLINGITE
- Écrit par Yannick LOZAC'H
- 306 mots
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 629 mots
- 12 médias
L'atome d'arsenic possède cinq électrons de valence et trois places vacantes sur sa couche externe. Dans un cristal d'arsenic, chaque atome établit trois liaisons covalentes avec trois atomes premiers voisins. Ces liaisons forment un trièdre, l'angle entre deux liaisons étant égal à 92,8... -
OLIGOÉLÉMENTS
- Écrit par Jean LAVOLLAY
- 3 576 mots
- 1 média
- Afficher les 9 références
Voir aussi