SOUFRE
Présent à l'état natif dans les régions volcaniques, le soufre est connu depuis les temps les plus reculés. Il est cité dans la Bible et dans L'Odyssée. Son nom vient du sanscrit sulvere qui a donné sulfur en latin. Ses usages anciens furent la désinfection et la poudre noire. Les impuretés toujours présentes dans le soufre ont conduit les chimistes à lui supposer longtemps les compositions les plus variées : bitume pour Nicolas Lemery (1645-1715) ; mélange d'acide sulfurique et d'une substance volatile pour Johann Kunckel (1630 env.-1703 env.) ; cire naturelle pour de nombreux autres ; il est enfin considéré comme élément par Antoine Laurent de Lavoisier et par Louis-Joseph Gay-Lussac, ce qui n'empêche pas Humphry Davy de lui attribuer une composition analogue à celle des hydrocarbures. Le soufre formerait 0,06 p. 100 du poids de la croûte terrestre jusqu'à 20 km de profondeur. Quoique faisant partie, dans le tableau de Mendeleïev, du même groupe que l'oxygène, il s'en distingue par une variété exceptionnelle d'aspects et de réactions.
Par action du soufre élémentaire sur des substances organiques, beaucoup de composés, sulfurés ou non, peuvent être obtenus, avec formation, en général, d'hydrogène sulfuré. Un cas particulièrement important de ces réactions est la vulcanisation du caoutchouc qui, par action du soufre sur un caoutchouc naturel, fournit un produit ayant de meilleures propriétés mécaniques. On pense que la vulcanisation provient d'une réticulation du caoutchouc naturel par la formation de liaisons chimiques, par l'intermédiaire d'atomes de soufre, entre les macromolécules qui le constituent.
Les types de composés organiques sulfurés sont très nombreux, et, si l'analogie du soufre et de l'oxygène, qui appartiennent à la même famille de la classification périodique des éléments, peut être invoquée pour décrire certains dérivés sulfurés, ce n'est pas toujours le cas et de très loin.
La chimie organique du soufre comprend, en effet, nombre de composés qui n'ont aucune contrepartie dans la chimie organique des dérivés oxygénés.
L'analogie se manifeste essentiellement quand le soufre est divalent, encore qu'il y ait, là aussi, de notables différences. Les dérivés du soufre quadrivalent peuvent être rapprochés de l'anhydride sulfureux SO2, et les dérivés du soufre hexavalent de l'anhydride sulfurique SO3.
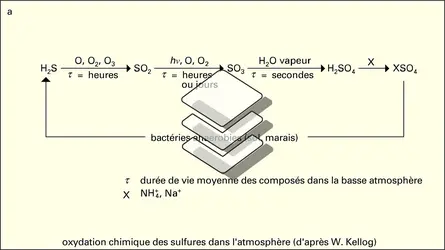
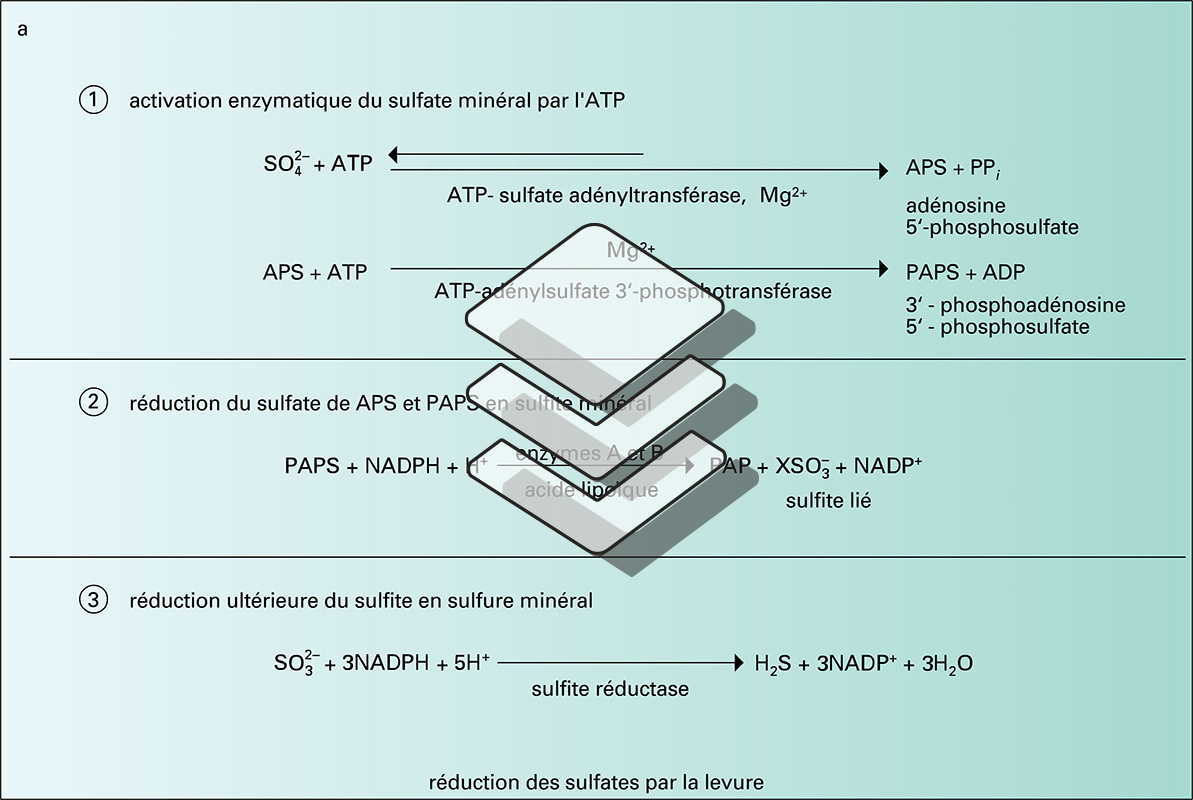
La description du métabolisme des diverses substances contenant du soufre nécessite une extrême schématisation. En effet, le soufre existe dans la nature et dans les organismes vivants (animaux, végétaux et micro-organismes) sous des formes très variées, tant minérales (sulfures métalliques, sulfates) qu'organiques : acides aminés (méthionine et cystéine), vitamines et coenzymes (thiamine, coenzyme A et biotine), antibiotiques. Il existe également dans le cartilage des animaux supérieurs sous forme d'acide chondroïtine-sulfurique. Or les voies de synthèse ou de dégradation de ces substances ne sont pas les mêmes dans tous les organismes considérés.
Le soufre est un produit d'une grande importance industrielle (cf. acide sulfurique) : la production minière annuelle mondiale de soufre sous toutes ses formes est de 72 millions de tonnes en 2007. Les modes de production utilisés sont nombreux, depuis l'extraction à la vapeur jusqu'au traitement des pétroles en passant par le grillage des sulfures métalliques. Cette diversité d'origine, donc de prix de revient, complique l'équilibre entre la production et la consommation. Aussi, malgré les efforts réalisés pour améliorer cette situation, le marché du soufre est-il instable.
L'élément soufre
Propriétés physico-chimiques
Le soufre possède un atome dont la couche externe contient six électrons. Cette couche se divise en deux[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Fernande CHATAGNER : maître de recherche au C.N.R.S.
- René LECLERCQ : vice-président de l'Institut International du soufre
- Noël LOZAC'H : doyen honoraire de la faculté des sciences de Caen, professeur émérite de l'université de Caen
- Serge MASSON : directeur de recherche au C.N.R.S., Caen
Classification
Pour citer cet article
Fernande CHATAGNER, René LECLERCQ, Noël LOZAC'H et Serge MASSON. SOUFRE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
CARBURANTS
- Écrit par Daniel BALLERINI, Jean-Claude GUIBET, Xavier MONTAGNE
- 10 527 mots
- 9 médias
De façon générale, la fabrication du gazole fait intervenir deux grands types de réactions chimiques : la désulfuration et l'hydrogénation. La première permet d'atteindre de très bas niveaux de teneur en soufre maintenant spécifiés par les réglementations antipollution (10 ppm maximum... -
COLORANTS
- Écrit par Daniel FUES
- 6 772 mots
- 4 médias
Les colorants au soufre sont insolubles dans l'eau. Ainsi, leur application en teinture passe par une réduction alcaline pour aboutir à un composé soluble, appelé leucodérivé, qui de surcroît présente de l'affinité pour les fibres. Le colorant est ensuite réoxydé en sa forme insoluble, qui reste emprisonnée... -
CUIR
- Écrit par Laurent VILLA
- 11 144 mots
- 4 médias
Il en est de même des composés soufrés. La peau prétannée au soufre peut ensuite être tannée aux tanins végétaux. Elle se tanne plus rapidement et, tout en absorbant moins de tanin, fournit un cuir plus souple. Enfin, le cuir prétanné au soufre est susceptible d'absorber des quantités plus importantes... -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
À l'état réduit, le soufre (S) est un élément indispensable à la vie. À l'état oxydé de sulfate, il constitue le deuxième anion par ordre d'abondance dans les rivières et l'océan (après l'ion chlorure). Son cycle naturel est profondément perturbé, parce que les combustions de charbons et de certains... - Afficher les 24 références
Voir aussi
- VULCANISATION
- SULFURE DE CARBONE
- ANHYDRIDE SULFUREUX ou DIOXYDE DE SOUFRE
- SULFURES
- RÉGULATION MÉTABOLIQUE
- CONDUCTEURS ÉLECTRIQUES
- DISULFURES
- SULFOBACTÉRIES
- CHIMIQUES INDUSTRIES
- FLOTTATION
- CÉTONES
- ALDÉHYDES
- FRIEDEL & CRAFTS RÉACTIONS DE
- OXYDATION
- SULFONIQUES ACIDES
- SULFONATION
- SULFATES
- CYSTÉINE
- PHÉNOTHIAZINES
- MÉTHIONINE
- POLYSULFURES
- DÉSULFURATION
- CYSTATHIONURIE
- THIOFÈNE ou THIOPHÈNE
- MERCAPTANS ou THIOLS
- MÉTABOLIQUES MALADIES
- CYSTATHIONINE
- FRASCH PROCÉDÉ
- SULFOXYDES
- XANTHATES
- ORKLA PROCÉDÉ
- OUTOKUMPU PROCÉDÉ
- SULFONES
- THIAZOLE
- GRILLAGE DES MINERAIS
- HOMOCYSTÉINE
- HOMOCYSTINURIE
- TRANSMÉTHYLATION
- TRANSSULFURATION
- SULFHYDRIQUE ACIDE
- SOUFRE CYCLE DU
- RÉDUCTION, chimie
- ALLOTROPIE
- BIOSYNTHÈSES
- BIOÉNERGÉTIQUE
- ATMOSPHÈRE, chimie
- STÉRÉO-ISOMÉRIE
- CAOUTCHOUC NATUREL
- RÉGULATIONS BIOCHIMIQUES
- SÉRINE
- DÉFICITS ENZYMATIQUE & MÉTABOLIQUE
- ÉNERGIE FOSSILE ou COMBUSTIBLES FOSSILES