SOLVANTS
Comment fonctionne un solvant ?
La mise en solution d'un composé résulte d'un ensemble complexe d'interactions entre molécules de solvant et molécules (ou ions) en solution : c'est la solvatation.
Les interactions électrostatiques sont assimilables à des interactions ion-dipôle (avec un soluté ionique) ou dipôle-dipôle (avec un soluté moléculaire, caractérisé par son moment dipolaire).
Par ailleurs, un solvant est un diélectrique, dont la constante diélectrique ε fixe le pouvoir de dissociation des espèces ionisées ; celles-ci sont dissociées (ε grand) ou sous forme de paires d'ions (ε petit).
Les interactions spécifiques sont liées à la nature chimique du solvant. Ce sont de véritables liaisons chimiques entre soluté et solvant. Les liaisons hydrogène sont spécifiques des solvants protiques (susceptibles d'échanger des ions H+), comme l'eau, les alcools, les acides carboxyliques, les amides. Elles constituent des liaisons d'énergie relativement faible, entre l'hydrogène du solvant et un atome du soluté donneur de doublet électronique ou entre les molécules du solvant (qui est dit alors associé).
Plus fréquentes que les liaisons hydrogène, les liaisons de caractère donneur-accepteur du doublet électronique (réactions « acide- base », au sens de Lewis) sont mises en œuvre entre solvants donneurs (comme le diméthylsulfoxyde, les alcools, l'eau) et solutés accepteurs ou entre solvants accepteurs (acides carboxyliques, eau, etc.) et solutés donneurs. C'est cet ensemble de propriétés qui gouverne la miscibilité des solvants entre eux et leur aptitude à dissoudre des composés moléculaires ou ioniques.
La mise en solution fait également intervenir la réactivité chimique du solvant lui-même : c'est le phénomène de solvolyse, particulièrement important lorsque le solvant peut se dissocier selon un équilibre d'autodissociation.
Un solvant protique, symbolisé par HS, se dissocie légèrement suivant l'équilibre de solvolyse :
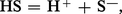
L'hydrolyse, qui caractérise la solvolyse de l'eau, limite le domaine de pH accessible, mais un changement de solvant permet d'élargir, de diminuer ou encore de déplacer considérablement ce domaine. Dans les solvants aprotiques, la solvolyse conduit à l'échange d'autres particules, par exemple l'ion oxyde (O2-) dans les sels fondus tels que les nitrates, sulfates, carbonates, etc. Les phénomènes de solvolyse s'interprètent alors selon le concept de solvoacidité qui élargit la notion d'acidité introduite pour interpréter les échanges d'ions H+.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques DEVYNCK : directeur de recherche au C.N.R.S.
Classification
Pour citer cet article
Jacques DEVYNCK. SOLVANTS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Média
Autres références
-
ACÉTONE
- Écrit par Roger GALLO
- 641 mots
Liquide volatil incolore, d'une odeur piquante, miscible avec l'eau, l'alcool, l'éther, le chloroforme et le benzène, l'acétone, ou diméthylcétone, ou propan-2-one, a pour formule brute C3H6O : un atome de carbone C est lié par des liaisons chimiques simples à deux...
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 089 mots
- 6 médias
...l'extension, lorsque les travaux de Linde et de Claude eurent fourni la possibilité d'extraire facilement l'oxygène de l'air. La préparation de solvants chlorés : trichloréthylène et perchloréthylène, entreprise dès 1910 en Allemagne, ne devait surtout se développer en France et dans les autres... -
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
En raison de sa charge élevée par rapport à son volume, H+ n'existe pas comme tel en solution, mais se fixe sur le solvant (dénommé SH) qui se trouve jouer ainsi le rôle de base. Par conséquent, l'ionisation d'un acide dans l' eau ne s'écrira pas :mais :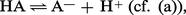 et la constante...
et la constante...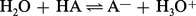
-
ALCOOL ÉTHYLIQUE ou ÉTHANOL
- Écrit par Fernand COUSSEMANT
- 694 mots
Alcool primaire, liquide incolore, d'odeur agréable, miscible à l'eau en toutes proportions, miscible à de nombreux solvants organiques, l'éthanol ou alcool éthylique, CH3—CH2OH, a les caractéristiques suivantes :
Masse moléculaire : 46,07 g
Masse spécifique : 0,789 3...
- Afficher les 45 références



