ISOMÉRIE, chimie
De même que l'anagramme d'un mot comporte les mêmes lettres que celui-ci, arrangées différemment, de même les molécules peuvent inclure les mêmes atomes, mais disposés autrement. Un exemple de tels « isomères », terme qui signifie « formés de parts égales », est la paire constituée de l'acide cyanhydrique HCN et de l'acide isocyanique HNC. Et de même qu'une loupe et une poule n'ont pas grand-chose en commun, en dehors des lettres de leur nom, de même des molécules isomères diffèrent à tous égards, hormis le fait qu'elles sont composées des mêmes atomes.
Émergence de la notion d'isomérie
La prise de conscience par les chimistes de l'existence de ce phénomène d'isomérie, ainsi baptisé par le Suédois Jöns Jakob Berzelius, date du premier tiers du xixe siècle. Durant la seconde moitié du même siècle, et dans une large mesure grâce aux travaux de Louis Pasteur sur les acides tartriques du vin, il s'avéra qu'il existait une classe particulière d'isomères, les énantiomères. Une paire d'énantiomères est telle que chacun est l'image de l'autre dans un miroir.
L'analogie avec les mots est à nouveau parlante. Des palindromes (rotor, radar) se lisent indifféremment dans l'un ou l'autre sens. De même, certains isomères, que l'on qualifie techniquement de méso, sont à eux-mêmes leur propre image. En effet, leurs molécules possèdent au moins un plan de symétrie. D'autres paires de mots – comme roc, cor ou lac, cal – sont l'équivalent à une dimension de ce que sont des molécules d'énantiomères, dans l'espace à trois dimensions.
Mentionnons ici le benzène C6H6, car la chimie progressa, surtout au xxe siècle, au moyen de la notion apparemment paradoxale d'isomères inexistants. Tel est le cas de la molécule de 1,3,5-cyclohexatriène, pour lui donner sa dénomination selon la nomenclature officielle. Elle est isomère du benzène. La première de ces molécules, si on l'isolait, montrerait une alternance de longueurs de liaisons carbone-carbone, trois courtes et trois longues. Le benzène, quant à lui, a des liaisons carbone-carbone toutes d'égale longueur. Un homologue supérieur du benzène, le 1,3,5,7-cyclooctatétraène C8H8, présente le cas exactement opposé (du reste complémentaire) : ici, l'isomère inexistant – tout au moins à très courte durée de vie – est la molécule plane, aux liaisons carbone-carbone toutes de même longueur.
Comme on le verra, isomérie et mésomérie (ou résonance) répondent à des problématiques entièrement distinctes. Dans les isomères, les atomes n'occupent pas la même position ; dans les « formes-limites » du formalisme de la résonance, seuls les électrons sont répartis différemment, les noyaux des atomes restant immuables.
Néanmoins, à un siècle d'écart (1830 et 1930, grosso modo), ces deux notions ont l'une et l'autre servi à mieux définir chacune des limites de certaines représentations que les scientifiques se font de la molécule. L'isomérie joua un grand rôle dans l'établissement des formules de structure durant la période 1850-1860. Elle permit à Achille Le Bel (1847-1930) et à Jacobus Henricus Van't Hoff (1852-1911) d'établir, indépendamment l'un de l'autre, le concept du carbone tétraédrique, c'est-à-dire porteur de quatre liaisons avec autant d'atomes placés aux sommets d'un tétraèdre. La mésomérie fut inventée par Linus Pauling, à partir de 1930 et sur le modèle que Kekulé avait inauguré à partir de 1865 avec sa formulation dédoublée pour le benzène. L'écriture de formules de Lewis, dont les limitations devenaient patentes avec des cas comme le monoxyde de carbone CO, était ainsi sauvegardée et devenait un puissant outil heuristique.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Pour citer cet article
Pierre LASZLO. ISOMÉRIE, chimie [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ALCANES
- Écrit par Jacques METZGER
- 3 614 mots
- 11 médias
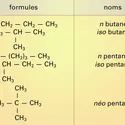
...quaternaires avec un atome primaire à l'extrémité de chacune des chaînes linéaires partielles, c'est alors un alcane ramifié présentant des nœuds iso ou néo. Les alcanes en C1, C2, C3 sont uniques mais, dès que la condensation en carbone est supérieure à 3, plusieurs formules développées correspondent à la même... -
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
...la présence, dans son enchaînement carboné, de deux atomes de carbone adjacents, hybrides sp2, tricoordinés et qui échangent entre eux deux liaisons. Aux isoméries de structure qu'ils ont en commun avec les alcanes, les alcènes présentent deux autres modes d'isomérie : l'isomérie de position caractérisée... -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
Lesamides primaires et secondaires existent sous deux formes isomères en équilibre, l'espèce « imino-alcool » étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l'état de dimères (formule 11), mais également... -
BENZÉNOÏDES
- Écrit par Jacques METZGER
- 5 520 mots
- 6 médias
L'isomérie de position des dérivés disubstitués du benzène se traduit, dans leur nomenclature, par les préfixes ortho- (-1,2), méta- (-1,3) ou para- (-1,4) ; dans le cas du naphtalène, les substitutions en positions -1, -4, -5 ou -8 correspondent à la lettre α, en positions -2, -3, -6 ou -7... - Afficher les 20 références
Voir aussi