ISOMÉRIE, chimie
Les avancées de Kekulé et de Lewis
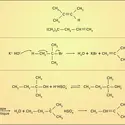
En 1865, Friedrich August Kekulé von Stradonitz émit l'hypothèse que les molécules dites aromatiques avaient en commun le cycle benzénique C6A6, où A est un atome quelconque. La notion de molécule cyclique, d'une chaîne refermée sur elle-même, venait élargir le champ de la structure moléculaire. L'hypothèse de Kekulé allait de pair avec la structure qu'il avançait pour la molécule de benzène C6H6, où devaient alterner selon lui liaisons carbone-carbone simples (C–C) et doubles (C=C). Il devint tout de suite évident à Kekulé qu' il lui fallait postuler la coexistence de deux formules de ce type : si on numérote les atomes de carbone à la suite, de 1 à 6, la première formule de Kekulé peut se représenter C1–C2 et la seconde C1=C2.
Cette coexistence serait-elle un équilibre avec basculement alternativement d'une formule de Kekulé vers l'autre ? Telle fut la position initiale du chimiste allemand. Elle s'avéra intenable. Ses contemporains lui firent valoir que le dénombrement des isomères qu'on avait pu isoler, à la suite de la substitution du cycle benzénique, c'est-à-dire du remplacement d'un ou plusieurs atomes H par un ou des atomes A, exclut un tel équilibre. Un seul dérivé C6H5A est observé, et non deux. De même, on ne connaît que trois dérivés C6H4A2, trois dérivés C6H3A3, etc. Dès le début des années 1870, les chimistes admirent, sans le comprendre, qu'il leur fallait faire intervenir ensemble et simultanément les deux formules de Kekulé pour rendre compte de la structure du benzène.
Cette constatation empirique prévalut jusque vers 1930, aux débuts de la mécanique quantique et de ses toutes premières applications à la chimie. Entre-temps, les chimistes avaient appris de Gilbert Newton Lewis, depuis 1916, à écrire des formules faisant intervenir le décompte des électrons présents dans une molécule, qu'il s'agisse de paires d'électrons engagés dans des liaisons ou pas.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Pour citer cet article
Pierre LASZLO. ISOMÉRIE, chimie [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ALCANES
- Écrit par Jacques METZGER
- 3 614 mots
- 11 médias
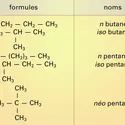
...quaternaires avec un atome primaire à l'extrémité de chacune des chaînes linéaires partielles, c'est alors un alcane ramifié présentant des nœuds iso ou néo. Les alcanes en C1, C2, C3 sont uniques mais, dès que la condensation en carbone est supérieure à 3, plusieurs formules développées correspondent à la même... -
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
...la présence, dans son enchaînement carboné, de deux atomes de carbone adjacents, hybrides sp2, tricoordinés et qui échangent entre eux deux liaisons. Aux isoméries de structure qu'ils ont en commun avec les alcanes, les alcènes présentent deux autres modes d'isomérie : l'isomérie de position caractérisée... -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
Lesamides primaires et secondaires existent sous deux formes isomères en équilibre, l'espèce « imino-alcool » étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l'état de dimères (formule 11), mais également... -
BENZÉNOÏDES
- Écrit par Jacques METZGER
- 5 520 mots
- 6 médias
L'isomérie de position des dérivés disubstitués du benzène se traduit, dans leur nomenclature, par les préfixes ortho- (-1,2), méta- (-1,3) ou para- (-1,4) ; dans le cas du naphtalène, les substitutions en positions -1, -4, -5 ou -8 correspondent à la lettre α, en positions -2, -3, -6 ou -7... - Afficher les 20 références
Voir aussi