MÉSOMÉRIE
On rencontre parfois des cas où un choix ne peut être fait entre plusieurs structures à peu près également stables d'un même corps et dont aucune ne permet à elle seule de rendre compte de toutes les propriétés de la substance. On appellera mésomérie l'état d'une telle molécule, la forme stable étant intermédiaire entre les structures extrêmes ; on dit parfois qu'il y a résonance plutôt que mésomérie.
Aucune formule classique ne peut exprimer la délocalisation des électrons, et la structure des molécules qui en sont le siège peut être schématisée seulement à l'aide d'un ensemble de plusieurs formules classiques.
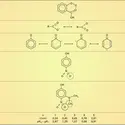
Ainsi, l'ion carbonate CO2— dont on vérifie expérimentalement le haut degré de symétrie et la planéité, est décrit comme la superposition de trois structures mésomères dépeignant sa configuration électronique.
Un autre exemple important est celui du benzène dont la structure réelle est intermédiaire entre les formules de Kekulé et, à un degré moindre, celles de Dewar.
Les structures mésomères dont l'hybridation permet de décrire la molécule réelle doivent toutes montrer les atomes dans la même position (différence avec une isomérie, comme la tautomérie), contenir le même nombre d'électrons non appariés et isolés (sinon, le spin global et les propriétés magnétiques ne seront pas conservés) et avoir des énergies comparables. L'état réel de la molécule sera une hybridation des formes mésomères où le poids de chacune des formes résonnantes sera fonction de sa nature et de sa stabilité. La molécule est stabilisée par cette résonance, l'énergie réelle étant plus faible que celle de l'une quelconque des structures possibles.
Outre les exemples déjà donnés, la théorie de la mésomérie permet d'expliquer les structures aromatiques aussi bien que la couleur de colorants comme le vert malachite ; elle est vérifiée expérimentalement par la mesure des distances de liaison.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard CARTON : docteur ès sciences, attaché de recherche au C.N.R.S.
Classification
Pour citer cet article
Bernard CARTON. MÉSOMÉRIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
Un acide carboxylique s'ionise en un anion mésomère (formule 2), si bien qu'en fait la charge négative est répartie entre les deux atomes d'oxygène, donnant une structure intermédiaire entre les précédentes (on dit qu'il y a résonance entre celles-ci). La structure réelle... -
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
...d'oxydation et non pas moitié de degré III et moitié de degré V. Pour expliquer ces faits, Linus Pauling a suggéré qu'il pourrait s'agir d'un cas de mésomérie, la formule réelle étant intermédiaire entre les deux cas limites (SbX6)3 - et (SbX6) - de structure cristalline identique. -
ISOMÉRIE, chimie
- Écrit par Pierre LASZLO
- 1 787 mots
- 1 média
Une molécule quelconque, dans cette description due à Pauling, et que l'on qualifie aussi de mésomérie, existe simultanément sous divers visages, ou formes-limites. Ainsi, les formules de Kekulé sont deux des formes-limites (il en existe d'autres) pour la molécule de benzène. Aucune de ces formules (de... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
...associées à chaque forme canonique. La molécule sera donc décrite par une fonction intermédiaire entre les fonctions de base, d'où le nom de structure mésomère donné à la structure réelle de la molécule (du grec μεσος, intermédiaire) et le nom de mésomérie donné à la méthode. On note aussi...