FLUOR
Applications
Le fluor et surtout ses dérivés connaissent de multiples applications dans des domaines variés.
Le fluor est utilisé en thérapeutique. Son emploi le plus courant est la prophylaxie de la carie dentaire. À cet effet, certains pays introduisent systématiquement du fluor dans les eaux de consommation. Le fluorure de sodium sert pour le traitement des retards de calcification. Le fluor est également utilisé dans des médicaments de nature organique, où il peut, selon les cas, exalter ou diminuer certaines actions biologiques. Citons entre autres exemples la 9-α-fluorohydrocortisone, anti-inflammatoire puissant, dont l'action est dix fois plus forte que celle de l'hydrocortisone.
La plus ancienne utilisation d'un composé fluoré est sans doute la gravure sur verre réalisée à l'aide d'acide fluorhydrique dès le xviie siècle. Cet acide sert actuellement à de nombreuses synthèses organiques et en particulier à l'alkylation de l'essence.
Les C.F.C. sont apparus comme réfrigérants dans les années 1930, constituant avec l'ammoniac les principaux fluides frigorigènes. En effet, ces composés possèdent des points d'ébullition extrêmement différents suivant leur composition. Les C.F.C. servirent aussi à la fabrication de mousses synthétiques et furent utilisés comme gaz propulseurs dans les aérosols. Mais, en 1974, les chimistes Mario Molina et Franck Sherwood Rowland démontrèrent que les C.F.C. augmentaient les quantités de chlore et d'oxyde de chlore dans la stratosphère, où ces corps réagissent avec l'ozone et contribuent à la destruction de celui-ci, ce qui accroît l'effet de serre et le réchauffement climatique. Des réglementations se sont donc mises lentement en place (protocole de Montréal, 1987) afin d'interdire la production, le commerce et l'emploi des C.F.C.
Les hauts polymères fluorés huileux ou solides, dont le Téflon® est le plus commun, ont une importance industrielle considérable en raison de leur remarquable résistance à la corrosion.
Certains composés fluorés sont de puissants catalyseurs industriels. C'est le cas de BF3 qui, employé dans la condensation des hydrocarbures éthyléniques avec les hydrocarbures saturés, permet l'obtention d'hydrocarbures à indice d'octane élevé.
La séparation de l'uranium 235, isotope dont la fission est à l'origine de l'énergie nucléaire, de son isotope l'uranium 238 nécessite, quel que soit le procédé utilisé (diffusion ou ultracentrifugation), l'emploi d'un composé gazeux de l'uranium. Seul le fluorure UF6 possède cette propriété, ce qui explique l'étroite liaison de la chimie du fluor avec les techniques nucléaires. La manipulation de l'hexafluorure d'uranium pose de nombreux problèmes en raison de son hygroscopicité, qui entraîne la formation d'oxydes ou d'oxyfluorures d'uranium solides diminuant le rendement de la séparation et d'acide fluorhydrique provoquant d'importantes corrosions :
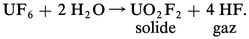
Le fluor peut être également utilisé dans le domaine spatial. En effet, la réaction du difluor sur le dihydrogène, qui provoque la formation d'hydrogène fluoré, libère une énergie considérable. Le mélange difluor-dihydrogène présente une impulsion spécifique supérieure à celle obtenue avec les mélanges dioxygène-dihydrogène employés pour la propulsion des fusées. Si l'utilisation du fluor liquide est limitée par les problèmes de corrosion, il semble cependant que le fluorure d'oxygène F2O, moins corrosif que le fluor, soit utilisé.
Le dépôt de films minces de fluorures métalliques, comme le fluorure de magnésium sur les lentilles d'appareillages optiques, diminue l'intensité de la lumière réfléchie et augmente donc la luminosité. La cryolite Na3AlF6 sert de fondant de l'alumine dans la métallurgie[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Josik PORTIER : directeur de recherche au C.N.R.S.
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis et Josik PORTIER. FLUOR [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
APATITES
- Écrit par Jean-Claude LUBIN
- 801 mots
Phosphates de chaux naturels, Ca5(PO4)3(OH,F,Cl), les apatites sont des minéraux accessoires des roches éruptives et métamorphiques, fréquents en outre dans les gîtes phosphatés sédimentaires. Le terme, créé en 1808 par Werner, vient du grec apataein (tromper). En effet, on peut confondre...
-
ÉLASTOMÈRES ou CAOUTCHOUCS
- Écrit par Christian HUETZ DE LEMPS, Françoise KATZANEVAS
- 7 896 mots
- 9 médias
Les fluorocarbonés constituent une autre famille d'élastomères très performants. Ils sont composés de 65 à 72 p. 100 de fluor, ce qui leur confère une très grande inertie chimique et thermique. Ils peuvent ainsi être utilisés jusqu'à des températures de l'ordre de + 250 0C.... -
FLUORURE D'HYDROGÈNE
- Écrit par Bernard CARTON
- 614 mots
Formule brute : HF
Masse moléculaire : 20,01 g
Point d'ébullition : 19,5 0C
Point de fusion : — 83,1 0C
Température critique : 188 0C.
Gaz incolore d'odeur piquante fumant dans l'air.
Le fluorure d'hydrogène bout déjà à la température ordinaire, mais, refroidi, il forme un liquide...
-
FLUORURES NATURELS
- Écrit par Guy ROGER
- 1 282 mots
- 3 médias
Les fluorures naturels constituent les principales combinaisons du fluor dans l'écorce terrestre et pratiquement les seuls minerais exploitables de cet élément. Celui-ci se trouve pourtant dans beaucoup d'autres minéraux (apatites, silicates), ainsi que dans les fumerolles et certaines sources chaudes....
- Afficher les 12 références
Voir aussi
- TOXICITÉ
- CATALYSEURS
- SÉPARATION ISOTOPIQUE
- CHIMIQUES INDUSTRIES
- FLUORINE ou FLUORITE ou SPATH FLUOR
- CRYOLITHE
- HALOGÉNÉS DÉRIVÉS
- ÉNERGIE NUCLÉAIRE
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- CARIE DENTAIRE
- FLUORHYDRIQUE ACIDE
- DIFLUOR
- OXYDES
- FLUORURES
- ÉLECTROLYSE
- NUCLÉAIRE INDUSTRIE
- HEXAFLUORURE D'URANIUM
- RÉACTIVITÉ CHIMIQUE
- CHLOROFLUOROCARBURES (CFC)



