FLUORURE D'HYDROGÈNE
Formule brute : HF
Masse moléculaire : 20,01 g
Point d'ébullition : 19,5 0C
Point de fusion : — 83,1 0C
Température critique : 188 0C.
Gaz incolore d'odeur piquante fumant dans l'air.
Le fluorure d'hydrogène bout déjà à la température ordinaire, mais, refroidi, il forme un liquide léger, mobile et très hygroscopique. Au point d'ébullition et sous forte pression, il a un poids moléculaire correspondant à la formule H4F4, mais il se dissocie par baisse de la pression ou par élévation de la température ; ce n'est qu'à partir de 85 0C qu'il ne contient que des molécules HF. Au-delà de cette température, sa masse moléculaire reste invariable. Pour le liquide ou le solide, on ne peut pas donner une formule sûre, à cause de l'état variable de polymérisation. Il a donc des propriétés physiques anormales par rapport à celles des autres halogénures d'hydrogène. À l'état liquide, il a une constante diélectrique voisine de celle de l'eau. Il se mélange à l'eau en toutes proportions en donnant des solutions désignées par le nom d'acide fluorhydrique et qui, contrairement aux autres halogénures d'hydrogène qui sont des acides forts, sont des acides faibles (très partiellement ionisés) et dont le degré de dissociation dépend de l'état de polymérisation. La solution commerciale contient 40 p. 100 de fluorure d'hydrogène (d = 1,13) environ, doit être manipulée avec soin et surtout ne pas être respirée, car elle attaque fortement tous les tissus de l'organisme. La solution à 35,35 p. 100 en poids constitue un mélange azéotropique dont la température d'ébullition est de 120 0C.
L'acide fluorhydrique se comporte comme un quadriacide de formule (HF)4, formant quatre séries de sels, parmi lesquels les alcalins sont tous très solubles dans l'eau et complètement ionisés en solution diluée. Tous les sels solubles sont des antiseptiques forts.
On prépare le fluorure d'hydrogène par action de l'acide sulfurique sur la fluorine (spath-fluor, CaF2) pulvérisée en chauffant légèrement :
CaF2 + H2SO4 → H2F2 + CaSO4.
On opère dans des récipients en platine ou en cornues de plomb, et le gaz libéré est recueilli par condensation dans des récipients en gutta-percha ou en verre entièrement paraffiné, car il attaque aussi bien le verre que la porcelaine (ainsi que tous les métaux, sauf le platine).
Le fluorure d'hydrogène sert à la préparation de nombreux sels minéraux et composés organiques du fluor utilisés dans l'industrie, comme par exemple le fluorure d'aluminium employé comme électrolyte pour la préparation de l'aluminium métallique. Plus particulièrement, l'industrie nucléaire en utilise de grandes quantités pour la fabrication de l'hexafluorure d'uranium, gaz servant à la concentration de l'uranium naturel en isotope 235 (fissile) par diffusion gazeuse. De nombreux mélanges de fluorochlorocarbures ou fluorobromocarbures sont employés comme mélanges réfrigérants (fréons) et comme gaz propulseurs des aérosols ou comme matières plastiques. Le fluorure d'hydrogène formé par action directe du fluor sur l'hydrogène dégage une grande quantité d'énergie et possède une excellente impulsion spécifique, d'où son emploi pour la propulsion des fusées (propergols). Il est aussi souvent employé comme catalyseur dans de nombreuses réactions organiques. L'industrie en emploie d'importantes quantités pour le nettoyage des métaux, le polissage et la gravure du verre.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard CARTON : docteur ès sciences, attaché de recherche au C.N.R.S.
Classification
Pour citer cet article
Bernard CARTON. FLUORURE D'HYDROGÈNE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
FLUOR
- Écrit par Universalis, Josik PORTIER
- 2 393 mots
- 1 média
...atmosphérique. C'est Henri Moissan qui, en 1886, réussit pour la première fois à l'isoler en électrolysant une solution de fluorure de potassium dans le fluorure d'hydrogène anhydre à l'aide d'électrodes de platine iridié auxquelles il appliquait une différence de potentiel de 50 V. Il maintenait... -
HALOGÈNES
- Écrit par Jacques METZGER, Robert de PAPE
- 6 600 mots
- 5 médias
...d'hydrogène, composés gazeux d'odeur acide :la comparaison des conditions de réaction permet d'apprécier les réactivités des halogènes : spontanée et explosive avec le fluor, même aux basses températures, elle doit être amorcée dans le cas du chlore, par exemple à l'aide d'un rayonnement...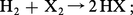
Voir aussi


