ESTERS
Préparations
Estérification des acides carboxyliques
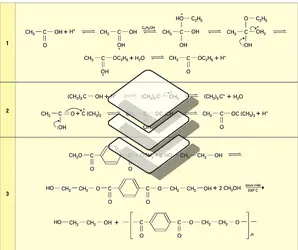
Les esters sont fréquemment préparés par action directe de l'acide sur l'alcool :
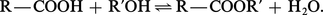
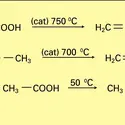
Cette réaction lente et réversible a fait l'objet d'une des premières études précises sur les équilibres chimiques en phase liquide. Pour des quantités équimoléculaires d'acide et d'alcool mises en réaction, le milieu renferme, à l'équilibre, une proportion d'ester et d'eau non pas sensible à la nature de l'acide, mais à celle de l'alcool. La limite oscille entre 0,66 et 0,73 pour les alcools primaires, 0,55 et 0,65 pour les secondaires et reste inférieure à 0,10 pour les alcools tertiaires. La vitesse d'établissement de l'équilibre varie considérablement avec la nature de l'acide et de l'alcool. Elle est d'autant plus grande que l'acide est plus fort et que l'alcool est moins encombré. À température ambiante, un mélange équimoléculaire d'acide acétique et d'éthanol met plusieurs mois pour atteindre la limite de l'équilibre ; à 100 0C, il faut plusieurs jours. La catalyse acide permet d'accélérer la réaction : l'acide carboxylique, transformé en son acide conjugué, réagit plus rapidement avec le nucléophile alcool (réactions). En pratique, on déplace l'équilibre soit en mettant en réaction un grand excès d'alcool (dans le cas du méthanol en particulier), soit en éliminant l'eau par distillation azéotropique, avec du benzène par exemple. Le mécanisme d'activation catalytique de l'acide carboxylique par l'acide fort est celui de l'estérification des alcools primaires et secondaires ; dans le cas des alcools tertiaires, un autre mécanisme intervient et ce sont eux qui, protonés, subissent une hétérolyse unimoléculaire en éliminant une molécule d'eau. Le carbocation formé, très électrophile, attaque l'acide carboxylique qui, dans ce cas, est le nucléophile (réactions).
L'estérification des acides carboxyliques peut également se réaliser avec un alcène. Le catalyseur acide le protone et le transforme en carbocation ; la réaction se poursuit comme dans le cas des alcools tertiaires. Bien que cette méthode soit bien adaptée à la préparation d'esters d'alcools tertiaires, un procédé industriel s'est développé pour fabriquer l'acétate d'éthyle à partir de l'éthylène.
Une méthode sélective et douce, utilisée au laboratoire pour transformer un acide carboxylique en ester méthylique, fait réagir le diazométhane.
Estérification des fonctions dérivées
Les sels de sodium des acides carboxyliques, même très encombrés, réagissent rapidement, à température ordinaire, avec les bromures et iodures d'alkyle primaires et secondaires, dans un solvant aprotique polaire comme l'hexaméthylphosphotriamide (HMPT), en donnant d'excellents rendements en ester.
L' alcoolyse des chlorures d'acides est la meilleure méthode générale pour préparer les esters. Une base est fréquemment ajoutée pour fixer l'acide chlorhydrique formé ; le procédé de Schotten-Baumann utilise la soude aqueuse.
L'alcoolyse des anhydrides d'acides permet également d'obtenir les esters. Moins réactifs que les chlorures, ils doivent être activés, notamment par la pyridine qui les transforme en cations N-acylpyridinium très électrophiles.
L'alcoolyse des esters, catalysée par les acides ou les bases, permet de transformer un ester d'acide carboxylique en un autre ester du même acide. C'est une réaction équilibrée qui doit être réalisée avec un excès de l'alcool ou en éliminant un produit volatil formé. Un exemple industriel important est la transestérification du téréphtalate de diméthyle par le glycol pour obtenir le téréphtalate de bis-(hydroxy-2-éthyle) qui est le monomère du Tergal ; le méthanol est éliminé[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ESTERS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
Les acétates organiques, autrement dit les esters, sont beaucoup plus importants. Ce sont d'excellents solvants en particulier des nitrates et des acétates de cellulose. Par ailleurs, en présence d'éthanolate de sodium, l'acétate d'éthyle a la propriété de se condenser sur lui-même avec élimination... -
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 355 mots
- 2 médias
La méthode la plus classique de préparation est la condensation, selon Claisen, de l'ester énolisable acétate d'éthyle, en présence d'un catalyseur basique (éthylate ou amidure de sodium). La base forte arrache un proton à l'acétate d'éthyle pour former, dans une réaction équilibrée, le carbanion conjugué... -
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
La saponification d'esters d'alcools gras naturels, présents dans les cires, libère l'alcool en formant un sel alcalin de l'acide gras (savon). Par exemple, le traitement par la soude du palmitate de cétyle, principal constituant du blanc de baleine, soustrait l'alcool cétylique et forme le palmitate... -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
...animales et végétales (cérides), sont des esters d'acides gras et d'alcools à longue chaîne : le blanc de baleine ou palmitate de cétyle est l' ester de l'acide palmitique C15H31CO2H et de l'alcool cétylique C15H31CH2OH (hexadécanol), tandis que la cire de Carnauba renferme en particulier... - Afficher les 14 références
Voir aussi