ESTERS
Propriétés physiques
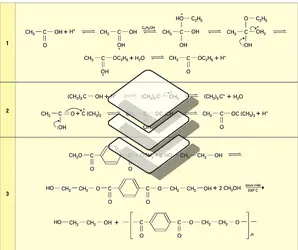
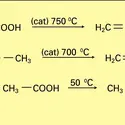
Les esters sont généralement des liquides, mais le premier terme, H−CO2CH3, bout à 32 0C. Leur point d'ébullition est inférieur à celui de l'acide correspondant, du fait de l'absence d'association : par exemple, les esters méthyliques (éthyliques) bouillent à une température inférieure d'environ 62 0C (42 0) à celle des acides. Généralement en mélanges, ils sont responsables de la flaveur (goût) et de la fragrance (odorat) de nombreux fruits. Les arômes alimentaires font intervenir de nombreux esters naturels (ou identiques au naturel) et les parfums synthétiques en contiennent également un grand nombre. À titre d'exemple, le formiate de méthyle a l'odeur du rhum, l'acétate d'isobutyle celle de la banane, le butyrate de méthyle celle de la pomme, le butyrate d'éthyle celle de l'ananas et le butyrate d'isoamyle celle de la poire. Une formule reproduisant la flaveur de framboise met en œuvre neuf esters, deux acides carboxyliques, l'acétaldéhyde, le glycérol et l'éthanol.
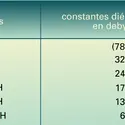
Peu ou pas solubles dans l'eau, sauf les tous premiers termes, ils sont en général de bons solvants ; l'acétate d'amyle, en particulier, dissout les esters cellulosiques (acétate, nitrate), ce qui permet la fabrication de films.
La fonction ester est caractérisée, en infrarouge, par une bande intense dans la région de 1 750-1 740 cm-1.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ESTERS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
Les acétates organiques, autrement dit les esters, sont beaucoup plus importants. Ce sont d'excellents solvants en particulier des nitrates et des acétates de cellulose. Par ailleurs, en présence d'éthanolate de sodium, l'acétate d'éthyle a la propriété de se condenser sur lui-même avec élimination... -
ACÉTYLACÉTIQUE ESTER
- Écrit par Jacques METZGER
- 1 355 mots
- 2 médias
La méthode la plus classique de préparation est la condensation, selon Claisen, de l'ester énolisable acétate d'éthyle, en présence d'un catalyseur basique (éthylate ou amidure de sodium). La base forte arrache un proton à l'acétate d'éthyle pour former, dans une réaction équilibrée, le carbanion conjugué... -
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
La saponification d'esters d'alcools gras naturels, présents dans les cires, libère l'alcool en formant un sel alcalin de l'acide gras (savon). Par exemple, le traitement par la soude du palmitate de cétyle, principal constituant du blanc de baleine, soustrait l'alcool cétylique et forme le palmitate... -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
...animales et végétales (cérides), sont des esters d'acides gras et d'alcools à longue chaîne : le blanc de baleine ou palmitate de cétyle est l' ester de l'acide palmitique C15H31CO2H et de l'alcool cétylique C15H31CH2OH (hexadécanol), tandis que la cire de Carnauba renferme en particulier... - Afficher les 14 références
Voir aussi