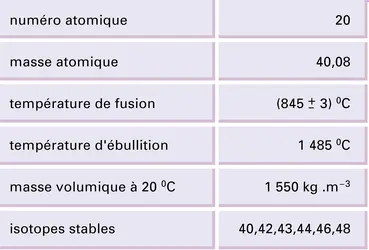
CALCIUM
Emplois du calcium et de ses composés
Le calcium lui-même est assez peu utilisé par la grande industrie. Au laboratoire, il peut servir à déshydrater des alcools sur lesquels, contrairement au sodium, il est sans action. Allié à d'autres métaux, comme l'aluminium, le béryllium, le cuivre ou le magnésium, il sert à parfaire le vide à l'intérieur des tubes électroniques en absorbant les dernières traces de gaz. Le calcium est utilisé comme réducteur, dans la métallurgie du plutonium et de l'uranium, pour libérer le métal de son tétrafluorure, sous atmosphère d'argon, dans un creuset protégé par un revêtement de fluorure de calcium. Le métal sert aussi de décarburant et de désoxydant au cours de l'affinage de certains aciers spéciaux.
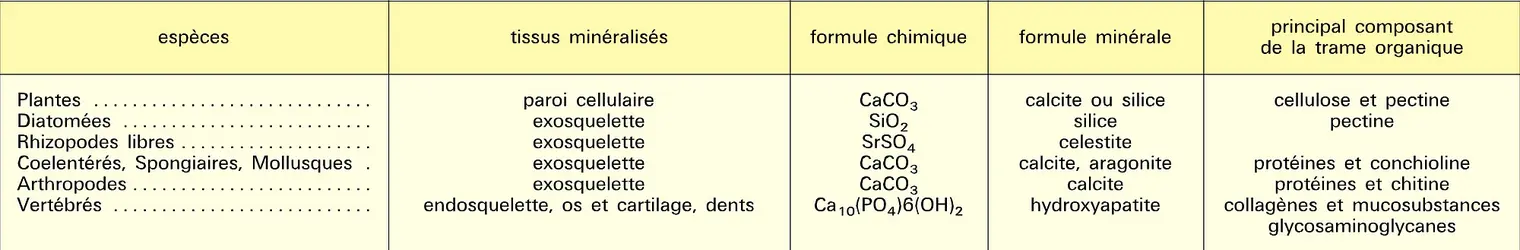
Le carbonate est la source, à la fois, du gaz carbonique et de la chaux après dissociation dans les fours à chaux vers 900 0C ; le procédé Solvay de préparation du carbonate de soude assure à ces deux produits un débouché important. La chaux est la plus employée, souvent sous forme de suspension ou « lait de chaux » à cause de sa faible solubilité ; on l'utilise aussi en général comme désinfectant des étables et écuries. Un tonnage important est consommé par des industries du bâtiment ; le ciment Portland est préparé par chauffage, vers 1 600 0C, d'un mélange de calcaire et d'argile. Par réhydratation, en présence d'un excès d'eau, la prise du ciment est due à la formation de longues aiguilles enchevêtrées de silicates hydratés cristallisés. Dans la métallurgie des fontes phosphoreuses, le procédé Thomas consiste à utiliser des convertisseurs recouverts intérieurement de dolomite, qui favorise l'élimination du phosphore sous forme de phosphates ; le résidu ou scorie de déphosphoration est un engrais apprécié. L' hypochlorite de calcium, ou chlorure de chaux, fait partie des chlorures décolorants. On le produit par action d'un courant de chlore sur de la chaux éteinte à l'état solide. Ses emplois principaux sont le blanchiment, la désinfection et la destruction des produits de fermentation ammoniacale avec dégagement d'azote. Le sulfate a retrouvé son rôle de matière première dans l'industrie de l'acide sulfurique. Le prix du soufre subissant des écarts très importants, en relation avec l'évolution mondiale du cours des matières premières, les pays consommateurs cherchent à limiter leurs importations. Dans ce but, on calcine des mélanges d'anhydrite, de silice, d'alumine et d'oxyde de fer ; outre le trioxyde de soufre qui se dégage, le résidu est un ciment de bonne qualité.
Les phosphates naturels sont essentiellement constitués de sels de calcium. Après traitement par l'acide sulfurique, on produit de l'acide phosphorique et des dérivés solubles utilisables comme engrais phosphatés. Le produit résiduel est du sulfate de calcium nommé « phospho-gypse », à cause de son origine, bien qu'il ne contienne plus de phosphore. Rarement commercialisable, son déversement dans les fleuves a provoqué des pollutions importantes.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean PERROTEY : docteur ès sciences, maître assistant à l'université de Haute-Normandie
Classification
Pour citer cet article
Jean PERROTEY. CALCIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIDIFICATION DES OCÉANS
- Écrit par Paul TRÉGUER
- 2 201 mots
- 5 médias
...actuel, avec un pH de 8,1, la concentration en bicarbonates domine largement celle des carbonates et celle du CO2 libre dissous. Dans ces conditions, les ions calcium (Ca2+) de l'eau de mer réagissent avec les bicarbonates pour former du carbonate de calcium (CaCO3) ou calcaire. Ce composé peut précipiter... -
ALIMENTATION (Aliments) - Classification et typologie
- Écrit par Ambroise MARTIN
- 4 590 mots
- 1 média
...dérivent) est le plus largement utilisé. Tous les laits sont des sources de protéines animales de bonne qualité, de différentes vitamines et de minéraux. Aujourd'hui, ils sont essentiellement valorisés pour leur teneur en calcium, élément dont l'intérêt est largement démontré pour la santé de l'... -
AUDITION - Acoustique physiologique
- Écrit par Pierre BONFILS, Yves GALIFRET, Didier LAVERGNE
- 14 809 mots
- 17 médias
...de liaison avec la calmoduline nécessaire à la régulation du système par le calcium. Lorsque la tension du ressort ouvre les canaux de transduction, le Ca++ entre avec le K+ et l'accumulation de Ca++ bloque le mécanisme ascensionnel de la myosine qui glisse vers la base, sollicitée par l'excès de... -
CHONDROCALCINOSE
- Écrit par Universalis
- 402 mots
Maladie « métabolique » caractérisée, au niveau des cartilages articulaires, par des calcifications (dépôt de microcristaux de pyrophosphate de calcium) visibles sur des radiographies, à partir de la cinquantaine, car cette affection augmente de fréquence avec l'âge de telle sorte que 25 p. 100...
- Afficher les 22 références
Voir aussi