OXALIQUE ACIDE ou ACIDE ÉTHANEDIOÏQUE
HOOC—COOH, 2 H2O
Masse moléculaire : 126,07 g
Masse spécifique : 1,68 g/cm3
Point de fusion : 189,5 0C
Point de sublimation : 150,0 0C.
Solide cristallin, incolore et translucide, l'acide oxalique ou acide éthanedioïque est le plus simple des diacides carboxyliques. Il a été découvert en 1776 par le chimiste suédois Carl Wilhelm Scheele dans l'oxydation du sucre. Présent à l'état naturel, essentiellement sous forme d'oxalate de calcium ou de potassium dans les racines et rhizomes de plantes telles que l'oseille, la rhubarbe ou la betterave, il intervient dans la constitution de certains minéraux (rognon de silex). L'acide oxalique apparaît également dans l'urine animale et humaine sous forme d'oxalate de calcium et d'acide oxalurique (H2N—CO—NH—CO—CO2H).
Il est généralement commercialisé sous forme de dihydrate soluble dans l'eau (12,5 p. 100 en poids à 25 0C) et faiblement soluble dans les solvants organiques. La forme anhydre hygroscopique HOOC—COOH est obtenue par chauffage du dihydrate à 100 0C. Elle est très soluble dans l'éthanol, peu dans l'éther et insoluble dans le benzène et le chloroforme.
L'acide oxalique est un réducteur doux ; oxydé par les ions permanganates en milieu acide, il est utilisé comme étalon en analyse volumétrique (manganimétrie) :
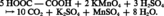
Il se transforme, à 160 0C, en monoxyde et dioxyde de carbone et se décompose, sous l'action de la lumière ultraviolette, en acide formique et dioxyde de carbone. Ses solutions aqueuses sont également sujettes à des réactions de photodécomposition. La facilité de formation de sels avec les métaux alcalins et en particulier avec l'ion calcium en font un composé toxique (la chélation du calcium entraîne un état hypocalcémique).
Cet acide était autrefois préparé par transformation du formate de sodium ou par fusion alcaline de la cellulose. Il est aujourd'hui synthétisé, selon la disponibilité de la matière première et l'économie du pays producteur, par oxydation nitrique de carbohydrates (de maïs aux États-Unis, de sucre en Inde et en Russie, de tapioca au Brésil), d'oléfines (propylène en France) ou encore d'éthylène glycol (Japon, Russie, États-Unis). De tels procédés mettent en jeu des réactions catalytiques.
– Oxydation nitrique des carbohydrates :

Oxydation nitrique du propylène :
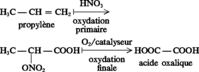
Le procédé Rhône-Poulenc fait intervenir deux oxydations successives : tout d'abord, par l'acide nitrique, puis par l'oxygène de l'air en présence d'un catalyseur. La plupart des applications de l'acide oxalique sont fondées sur ses propriétés réductrices, chélatantes et sur sa capacité de déplacer les ions métalliques et alcalino-terreux par formation d'oxalates. Il est utilisé pour des opérations de traitement de surface des métaux, pour le dérouillage et le polissage du marbre, comme agent de blanchiment (textile, papier, liège, cuir) et comme agent mordant pour la teinture de la laine. Il intervient dans la fabrication de polymères en tant qu'initiateur, mais aussi en tant que monomère pour la préparation de fibres et films plastiques — poly(éthylène oxalate) — présentant une résistance mécanique et un bon comportement à la chaleur. L'acide oxalique permet l'extraction de terres rares (lanthanides) ; il est également utilisé dans la préparation de supports magnétiques des bandes pour enregistrement. Dans l'industrie chimique, il sert à la préparation et à la réactivation de catalyseur. Enfin, il est employé comme réducteur doux dans certains procédés de développement photographiques.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Guy FOURNET : chargé de recherche au C.N.R.S. à l'université Claude Bernard, Lyon
Classification
Pour citer cet article
Guy FOURNET. OXALIQUE ACIDE ou ACIDE ÉTHANEDIOÏQUE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Autres références
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
Les acides α-cétoniques, l'acide oxalique et les β-diacides sont décarbonylés ou décarboxylés par chauffage et conduisent aux acides carboxyliques simples.
Voir aussi



