MICROSCOPIE
La révolution qui consiste, à la fin du xvie siècle, à regarder « à la loupe » non plus directement un objet, mais son image agrandie est à l'origine de la microscopie. L'étymologie (du grec mikros, petit, et skopein, examiner) renvoie à l'examen d'objets ou de détails d'objets à peine perceptibles ou invisibles à l'œil nu. La microscopie s'est ensuite progressivement imposée comme une technique d'observation indispensable pour accéder aux propriétés de la matière, inanimée ou vivante.
En introduisant de nouveaux modes d'observation et grâce à une perception de plus en plus fine, jusqu'à l'échelle atomique, la microscopie a ainsi bouleversé notre culture scientifique. Dans le seul domaine de la biologie, les illustrations sont nombreuses : c'est un microscope que Pasteur utilise pour découvrir les micro-organismes de la fermentation et en suivre l'évolution. L'importance de la microscopie optique dans les sciences de la vie à la fin du xixe siècle s'est encore confirmée au cours du xxe siècle grâce à de nouveaux microscopes. Toujours dans ce domaine, c'est la microscopie électronique qui a permis de progresser rapidement dans l'étude des ultrastructures.
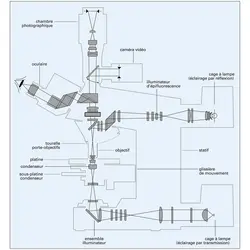
Le mode de production des images, leurs supports physiques, la nature et le traitement de l'information qu'elles contiennent ont conditionné l'évolution de la microscopie. L'image d'un objet résulte de la saisie d'informations caractéristiques de l'objet (forme, contour, couleur, etc.). Ces informations sont véhiculées par un rayonnement qui interagit avec l'objet. La production d'images par les microscopes traditionnels suppose donc :
– une source de rayonnement et un dispositif d'éclairage de l'objet ;
– une optique de transmission assurant la fonction d'agrandissement,
– un détecteur traduisant l'image sur un support (œil, plaque photographique, écran d'ordinateur pour des images numérisées) ;
L'image obtenue est généralement soumise à l'analyse et à l'interprétation du cerveau.
Par sa nature, le rayonnement détermine l'interaction avec l'objet. On distingue en particulier les objets d'amplitude et les objets de phase selon la caractéristique de l'interaction rayonnement-matière mise en jeu. L'interprétation de l'image fait donc appel à une connaissance précise des interactions rayonnement-matière.
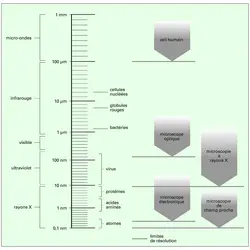
Par sa longueur d'onde, le rayonnement détermine la limite théorique des détails perceptibles sur l'image. Cette limite est imposée par les phénomènes de diffraction (critère de Rayleigh). En outre, la résolution dépend aussi, de façon cruciale, de la construction de l'ensemble qui véhicule l'information depuis l'objet jusqu'au support d'image.
La classification des microscopes traditionnels repose sur la nature du rayonnement. On distingue la microscopie optique (ou photonique), qui utilise les radiations électromagnétiques du spectre visible ou encore les radiations infrarouges ou ultraviolettes proches du visible et même des rayons X, de la microscopie électronique, qui, elle, utilise les propriétés ondulatoires de faisceaux d'électrons accélérés (cf. ondes - Physique), auxquels peut être associée une courte longueur d'onde ; elle atteint ainsi des résolutions bien meilleures que la microscopie optique.
Dans ces microscopies traditionnelles, les distances séparant la source de rayonnement de l'objet et du détecteur sont grandes par rapport à la longueur d'onde du rayonnement ; on est en régime de propagation ou de champ lointain.
Beaucoup plus récente, la microscopie de champ proche s'est rapidement développée à partir des succès du microscope par effet tunnel dans les années 1980. Ici, l'information est saisie à la source même[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Christian COLLIEX : directeur de recherche au C.N.R.S., responsable du groupe microscopie électronique, analytique et quantitative du laboratoire de physique des solides, Orsay
- Jean DAVOUST : directeur de recherche deuxième classe au C.N.R.S., responsable de l'équipe transport membranaire et fonctions lymphocytaires
- Étienne DELAIN : directeur de recherche au C.N.R.S., responsable du laboratoire de microscopie cellulaire et moléculaire de l'Institut Gustave-Roussy, Villejuif
- Pierre FLEURY : directeur honoraire de l'Institut d'optique théorique et appliquée de Paris, professeur honoraire au Conservatoire national des arts et métiers
- Georges NOMARSKI : directeur de recherche au C.N.R.S., Institut d'optique d'Orsay, professeur à l'Institut d'optique, responsable du laboratoire de microscopie, université de Paris-XI, Orsay.
- Frank SALVAN : professeur à la faculté des sciences de Luminy, université d'Aix-Marseille, directeur du laboratoire de physique des états condensés
- Jean-Paul THIÉRY : maître de recherche au C.N.R.S.
Classification
Pour citer cet article
Christian COLLIEX, Jean DAVOUST, Étienne DELAIN, Pierre FLEURY, Georges NOMARSKI, Frank SALVAN et Jean-Paul THIÉRY. MICROSCOPIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
MICROSCOPE, en bref
- Écrit par Danielle FAUQUE
- 264 mots
Il est difficile de dater avec précision la naissance du microscope. En 1615, Galilée (1564-1642) utilise un instrument à deux lentilles pour observer de petits objets et, en 1625, l'Accademia dei Lincei, à Rome, propose le mot microscopium. Les premiers microscopes présentent de graves...
-
MICROSCOPIE DU VIVANT
- Écrit par Didier LAVERGNE
- 190 mots
- 1 média
L'essor de l'anatomie microscopique à partir du xviie siècle a suivi l'invention d'instruments d'optique comportant des lentilles de verre qui permettent d'obtenir des images très agrandies en observant, à travers elles, de petits objets.
Les premiers naturalistes...
-
BACTÉRIOLOGIE
- Écrit par Jean-Michel ALONSO, Jacques BEJOT, Michel DESMAZEAUD, Didier LAVERGNE, Daniel MAZIGH
- 18 329 mots
- 11 médias
C'est alors qu'apparaissent les premiers microscopes ; grossissant très peu au début, formés d'une seule lentille, ce sont plutôt de fortes loupes ; peu à peu ils se perfectionnent, et aboutissent au dispositif actuellement utilisé qui combine plusieurs lentilles. -
BINNIG GERD KARL (1947- )
- Écrit par Bernard PIRE
- 230 mots
Né le 20 juillet 1947 à Francfort-sur-le-Main (Allemagne),Gerd Karl Binnig y fit ses études à l'université Goethe et obtint son doctorat en 1978. Immédiatement engagé par le laboratoire de recherche I.B.M. de Roschliken, près de Zurich, il travailla avec Heinrich Rohrer à la mise...
-
CANCER - Immunothérapie
- Écrit par Emmanuel DONNADIEU
- 5 131 mots
- 5 médias
...lymphocytes T sont des cellules très mobiles dans les tissus date d’une dizaine d’années seulement. C’est grâce à l’utilisation d’une nouvelle technique de microscopie, la microscopie biphotonique, que trois équipes américaines sont parvenues en 2002 à visualiser le comportement dynamique des lymphocytes T... -
CHARBON - Géologie
- Écrit par Robert FEYS
- 2 750 mots
- 3 médias
Mais la structure intime du charbon est restée longtemps mystérieuse ; c'est qu'on ne pouvait l'étudier au microscope suivant les techniques habituelles de la science des roches, une lame mince de houille restant opaque quelle que soit sa finesse. L'idée d'observer, par réflexion, au microscope métallographique,... - Afficher les 22 références
Voir aussi
- MATÉRIAUX SCIENCE DES
- FOCALISATION, physique
- ABSORPTION, physique
- CHAMP ÉLECTRIQUE
- CHAMP MAGNÉTIQUE
- TENSION ÉLECTRIQUE ou DIFFÉRENCE DE POTENTIEL ÉLECTRIQUE
- OBSERVATION
- IONISATION
- POUVOIR DE RÉSOLUTION
- INDICE DE RÉFRACTION
- MATÉRIAUX MAGNÉTIQUES
- COURANT ÉLECTRIQUE
- MICROSCOPIE ÉLECTRONIQUE
- MICROSCOPIE CONFOCALE
- MICROSCOPIE DE FLUORESCENCE
- MICROSCOPIE À CONTRASTE DE PHASE
- MICROSCOPIE À CONTRASTE INTERFÉRENTIEL
- MICROSCOPIE DE CHAMP PROCHE
- MICROSCOPIE À EFFET TUNNEL
- MICROSCOPIE À FORCE ATOMIQUE
- MICROSCOPIE OPTIQUE DE CHAMP PROCHE
- MICROSCOPIE IONIQUE À EFFET DE CHAMP
- OUVERTURE NUMÉRIQUE, microscopie
- FLUOROCHROMES ou FLUOROPHORES
- SONDE LOCALE, microscopie
- HYBRIDATION IN SITU
- MICROSCOPIE À FORCE MAGNÉTIQUE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE EN TRANSMISSION
- AUTORADIOGRAPHIE ou RADIOAUTOGRAPHIE
- OBJECTIF, optique
- DIFFRACTION ÉLECTRONIQUE
- APLANÉTISME
- FOYER, optique
- FOCALE DISTANCE
- GRANDISSEMENT, optique
- ABERRATION CHROMATIQUE
- FILTRAGE OPTIQUE
- LENTILLES, optique
- OPTIQUE INSTRUMENTALE
- GROSSISSEMENT, optique
- CHAMP, optique instrumentale
- ABERRATIONS, optique
- IMAGES OPTIQUES
- DIFFRACTION DE LA LUMIÈRE
- CONTRASTE DE PHASE
- ÉMISSION, physique
- ABERRATION SPHÉRIQUE
- FLUORESCENCE
- FIXATION, histologie
- OCULAIRE
- AIRY TACHE D'
- FOND NOIR, optique instrumentale
- POLARISATION DE LA LUMIÈRE
- CRISTALLOGRAPHIE
- DIFFRACTION PAR LES CRISTAUX
- BARRIÈRE DE POTENTIEL
- DÉFAUTS, cristallographie
- CONTRASTE INTERFÉRENTIEL
- STATIF
- ULTRAMICROSCOPIE
- WEHNELT
- BALAYAGE
- IMMERSION OBJECTIF À
- KÖHLER ÉCLAIRAGE DE
- FRONTALE DISTANCE, optique instrumentale
- BIRÉFRINGENCE
- CONDENSEUR, optique instrumentale
- MICROSCOPE BINOCULAIRE
- CANON À ÉLECTRONS
- CONTRASTE
- CASTAING MICROSONDE DE
- ÉCLAIRAGE
- ÉLECTRONIQUE, science et technique
- NUMÉRATION GLOBULAIRE
- ORGANITES CELLULAIRES
- COLORATION, cytologie
- ANTICORPS
- HISTOLOGIE MOLÉCULAIRE
- CYTOLOGIE ou BIOLOGIE CELLULAIRE
- MICROSCOPES
- IMMUNOHISTOCHIMIE
- SURFACES ANALYSE DES
- IMAGE ENREGISTREMENT & REPRODUCTION DE L'
- AMORPHES MATÉRIAUX
- CRYOFRACTURE
- RHODAMINE
- MICROSCOPIE ÉLECTRONIQUE À BALAYAGE
- MICROSCOPIE ÉLECTRONIQUE À TRANSMISSION
- LENTILLE MAGNÉTIQUE
- LONGUEUR D'ONDE
- LIMITE DE RÉSOLUTION
- MICROSCOPIE OPTIQUE
- LENTILLES ÉLECTRONIQUES
- OPTIQUE ÉLECTRONIQUE
- MACROMOLÉCULES BIOLOGIQUES
- PROFONDEUR DE CHAMP
- STRUCTURE CRISTALLINE
- MARQUAGE CHROMOSOMIQUE
- MARQUAGE IMMUNOCYTOLOGIQUE
- IMMUNOFLUORESCENCE
- MARQUAGE, biotechnologie
- PROTÉINES
- DENSITÉ ÉLECTRONIQUE
- DUALITÉ ONDE-CORPUSCULE
- TUNNEL EFFET
- IMAGE ou REPRÉSENTATION TRIDIMENSIONNELLE (3D)