MÉTAUX Gisements métallifères
Genèse des corps minéralisés
Il est impossible, ici, de nuancer chaque problème relatif à la genèse des gisements ; il faut donc considérer les propos qui vont suivre comme un cadre général qu'il est nécessaire d'adapter à chaque cas particulier et ne jamais oublier combien les hypothèses génétiques sont fragiles et précaires puisque pratiquement chaque découverte les remet en question. Par exemple, la découverte de gisements sédimentaires entraîne une remise en cause des gisements pyrométasomatiques. En effet, certains gisements se forment dans une assise carbonatée riche en silicates calciques, métamorphisée au contact d'un massif granitique qui peut d'ailleurs inclure localement des roches plus basiques que le granite. La présence fréquente de minéraux fluorés, borés et chlorés, de minéralisations en tungstène, molybdène, cuivre, magnétite suggère un apport émanant du granite, c'est-à-dire une métasomatose, d'où l'appellation de gisements pyrométasomatiques qu'on leur a donnée. Pourtant, la présence de ces minéraux métasomatiques n'est pas un critère suffisant pour décider de l'origine pyrométasomatique du gisement, ni leur absence pour en douter. Ainsi, un gisement de magnétite formé dans une roche carbonatée, métamorphisée au contact d'un granite, avec ou sans minéraux métasomatiques, peut être un gisement de fer sédimentaire, métamorphisée au contact du granite comme n'importe quelle autre roche. Un nouveau critère devient donc nécessaire pour prouver son origine sédimentaire (par exemple, des oolites épigénisées en magnétite) ou son origine pyrométasomatique (par exemple, un gradient géochimique se développant à partir du contact indépendamment de la géométrie des strates). Dès lors, il faudrait reconsidérer l'origine de tous les gisements dits pyrométasomatiques et, notamment, de ceux où les minéralisations se présentent en lits bien individualisés et très fins.
Sans tenir compte de la source du métal, il apparaît que la sédimentation, le plutonisme et le volcanisme sont générateurs de corps minéralisés tandis que l'altération météorique et l'érosion, le métamorphisme, la tectonique, les circulations d'eau ne font que concentrer et déplacer des minéralisations préalablement existantes, disséminées ou non, et dont l'origine première est due à l'un des phénomènes précédemment énumérés. Par exemple, on connaît des couches phosphatées susceptibles de renfermer de l'uranium, des schistes noirs, déposés en milieu peu profond, avec du cuivre, des massifs granitiques couronnés de coupoles greisenifiées à cassitérite (SnO2), des appareils ultrabasiques contenant des niveaux à chromite (Cr2O3) et du platine, mais on n'a pas mis en évidence de gisement caractéristique d'une zone de métamorphisme, d'un orogène, et les concentrations météoriques et hydatogènes dépendent étroitement du milieu où elles se produisent.
Il faut bien distinguer la genèse du gisement et l'origine des ions métalliques. Dans le cas d'un minerai sédimentaire (gisement exogène), l'origine du métal peut être superficielle, comme l'érosion de masses métallifères, ou profonde, liée à une activité volcanique régnant au moment de la sédimentation. L'origine du métal d'un minerai hydrothermal (gisement endogène) peut être sédimentaire, c'est-à-dire superficielle, le métal étant déplacé par l'activité hydrothermale d'un corps volcanique, ou bien profonde, le métal accompagnant directement le magma.
Les gisements sédimentaires
Les gisements sédimentaires sont souvent stratiformes, leur formation est synchrone du dépôt des sédiments (gisement syngénétique), ou légèrement postérieure : elle date alors du moment où les sédiments se compactent (gisement diagénétique[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Marie-José PAVILLON : maître assistante à la faculté des sciences de Paris
Classification
Pour citer cet article
Marie-José PAVILLON. MÉTAUX - Gisements métallifères [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 10/02/2009
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :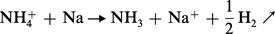
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 636 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références








