MATIÈRE (physique) État liquide
La notion de liquide est une notion familière, l'état liquide étant, avec l'état solide et l'état gazeux, l'un des trois états communs de la matière.
On peut étudier un liquide comme une phase condensée fluide. Cela signifie que le liquide a une masse spécifique élevée, proche de celle du solide, et qu'il est aisément déformable, au point d'adapter sa forme à celle des récipients dans lesquels il est placé, contrairement au solide. L'existence d'une tension superficielle confère aux liquides des propriétés spécifiques, comme les phénomènes capillaires.
À l'échelle de l'atome ou de la molécule, un liquide se révèle être une phase compacte partiellement désordonnée. Les propriétés des liquides dépendent fortement de la façon dont l'énergie d'interaction de deux molécules varie avec leur orientation et leur distance relatives. Dans les cas extrêmes, on peut voir apparaître des propriétés particulières, comme celles de cristal liquide.
La phase liquide
En général, dans le cas d'un corps pur, le changement d'état, c'est-à-dire le passage du solide au liquide ou du liquide au gaz, intervient à une température fixe qui reste constante tant que les deux phases sont en présence et qui ne varie qu'avec la pression.
Ces changements d'états sont réversibles. En l'absence de phénomènes parasites (surfusion), la fusion du solide se produit à la même température (point de fusion) que la solidification du liquide (point de solidification). De même, le point d'ébullition ou de vaporisation du liquide et le point de condensation du gaz sont identiques. La quantité de chaleur mise en jeu dans ces transformations, appelée chaleur latente du changement de phase considéré, est égale, au signe près, dans les transformations inverses. La fusion et la vaporisation sont des phénomènes endothermiques, alors que la solidification et la condensation sont exothermiques.
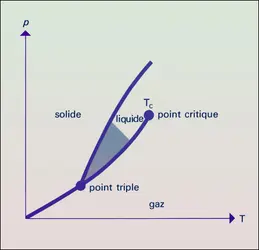
La variation de la pression sous laquelle se fait un changement d'état à température donnée est représentée sur le diagramme (p, T) de la figure 1. On y remarque un point triple qui correspond au point de coexistence des phases solide, liquide et gaz. À des températures ou à des pressions inférieures à celles du point triple, le liquide n'existe plus, et si un solide est chauffé à une pression inférieure à la pression du point triple, il se transforme directement en gaz (sublimation). De même, on peut constater que la courbe représentant les points d'ébullition s'arrête brusquement pour une certaine température, dite critique (Tc), au-dessus de laquelle il n'existe qu'une phase fluide. Au voisinage du point critique, la distinction entre liquide et gaz est donc relativement floue.
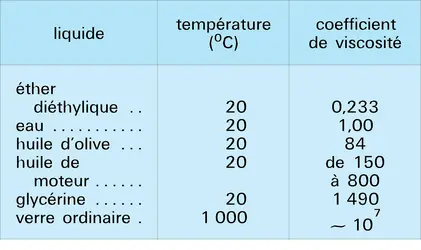
La distinction entre liquide et solide peut, elle aussi, être beaucoup moins nette qu'on le pense de prime abord. Il arrive en effet que, par abaissement de température, la fluidité du liquide diminue de façon importante et que l'on passe progressivement du liquide à un corps pâteux puis à un solide, que l'on qualifie alors de vitreux. C'est le cas du verre, ce qui permet son travail sous forme pâteuse, ainsi que de nombreuses matières plastiques (thermoplastiques) et de certains liquides moléculaires comme l'alcool éthylique (éthanol).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Louis RIVAIL : professeur de chimie théorique à l'université de Nancy-I
Classification
Pour citer cet article
Jean-Louis RIVAIL. MATIÈRE (physique) - État liquide [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ÉTAT DE LA MATIÈRE, notion d'
- Écrit par Bernard PIRE
- 1 521 mots
L'expérience quotidienne permet à chacun d'appréhender la notion d'état de la matière (parfois appelé phase) et celle de transition de phase qui lui est étroitement liée. L'exemple typique est celui des trois états si différents que prend l'eau lorsque sa température varie : à partir de 0 ...
-
MATIÈRE, notion de
- Écrit par Jean-Marc LÉVY-LEBLOND
- 2 022 mots
Le mot « matière » cache sous sa généralité abstraite une origine concrète fort éclairante. En latin archaïque, materia appartient à la langue rustique et désigne la substance dont est fait le tronc de l'arbre, en tant qu'elle est productrice (de branches, de feuilles). L'élargissement successif...
-
PARTICULES ÉLÉMENTAIRES
- Écrit par Maurice JACOB, Bernard PIRE
- 8 172 mots
- 12 médias
Les physiciens poursuivent l'étude de la structure de la matière dans le but de trouver plus d'unité et de simplicité dans un monde qui nous frappe par sa diversité et son apparente complexité. N'est-il pas remarquable de pouvoir ramener la variété quasi infinie des objets qui nous entourent...
-
ANTIMATIÈRE
- Écrit par Bernard PIRE, Jean-Marc RICHARD
- 6 931 mots
- 4 médias
...associé est bâti avec les antiquarks correspondants. Les mésons résultent de la liaison d'un quark et d'un antiquark. Dans cette description moderne, la matière est constituée par trois « générations » de quarks et de leptons, le nombre trois a été établi par les expériences du C.E.R.N. (laboratoire européen... -
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
L'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné. On connaît 90 éléments naturels auxquels s'ajoutent le ...
-
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
- Afficher les 37 références
Voir aussi
- HYDROGÈNE LIAISON
- LIQUIDE ÉTAT
- ÉTATS DE LA MATIÈRE
- POTENTIEL INTERMOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- EAU, physico-chimie
- PHASE TRANSITIONS DE
- ÉTAT CHANGEMENT D'
- ÉCOULEMENTS
- POINT CRITIQUE
- ÉNERGIE INTERNE
- DIAGRAMME, thermodynamique
- FUSION
- VAPORISATION
- POINT TRIPLE, thermodynamique
- LAMINAIRE ÉCOULEMENT
- LUBRIFICATION
- TENSION SUPERFICIELLE
- CAPILLARITÉ
- POISEUILLE LOI DE
- ÉBULLITION
- FONCTION DE DISTRIBUTION DE PAIRE
- TEMPÉRATURE CRITIQUE
- TEMPÉRATURE DE TRANSITION
- LENNARD-JONES POTENTIEL DE