COBALT
Composés
Il existe deux degrés principaux d'oxydation pour le cobalt, à savoir + 2 et + 3. Mais on connaît aussi quelques composés correspondant aux degrés inhabituels : − 1 dans l'hydrure de cobalt-tétracarbonyle H[Co(CO)4]qui a un caractère acide ; + 1 dans le perchlorate de cobalt (I)-bis (dipyridine) [Co(dipyr.)2][ClO4], par exemple ; + 4, enfin, dans les cobaltites (IV) de baryum ou de strontium : Ba2CoO4 ou Sr2CoO4.
Degré d'oxydation + 2
Les sels cobalteux donnent des hydrates et des solutions aqueuses colorées en rose. L'oxyde correspondant est CoO, de couleur grise, fondant à 2 078 0C, sans dissociation ; il est préparé en chauffant l'hydroxyde ou le carbonate à l'abri de l'air pour éviter une oxydation qui fournit l'oxyde salin Co3O4 appartenant au groupe des spinelles, stable jusqu'à 905 0C. Les solutions de sels de cobalt (II) traitées par un alcali donnent un précipité d'hydroxyde Co(OH)2 pour 7 ≤ pH < 8,5.
Le sulfure CoS, noir, est obtenu en précipitant les solutions de sels de cobalt (II) par H2S ou par le sulfure d'ammonium, pour un pH > 4.
Parmi les sels usuels, on citera : le chlorure anhydre CoCl2, bleu, rhomboédrique et son hexahydrate, rose, monoclinique ; le sulfate heptahydraté CoSO4, 7 H2O, rouge, en prismes monocliniques, donnant des sulfates doubles hexahydratés du type schoenite ; le nitrate hexahydraté Co(NO3)2, 6 H2O, gros prismes rouges monocliniques ; l'acétate tétrahydraté, rouge, monoclinique.
Parmi les complexes, on mentionnera les cobalt (II)-tétracyanures, les cobalt (II)-hexacyanures, les cobalt (II)-tétrathiocyanures, bleus, solubles dans l'eau et beaucoup plus encore dans l'alcool benzylique (dosage colorimétrique) ; les complexes hexacoordinés sont généralement à spin fort.
Tandis que les sels de cobalt (II) à l'état solide ou en solution ne s'oxydent pas à l'air, les complexes de cobalt (II) s'oxydent très facilement, surtout quand ils sont hexacoordinés, pour donner les complexes correspondants du cobalt (III).
Cela s'explique si on considère les valeurs des potentiels d'oxydoréduction :
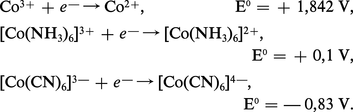
Les sels de cobalt (II), roses, bleus ou violets, changent de couleur sous l'influence de divers facteurs : variation de température ou de concentration, solvatation ou formation d'ions complexes.
Degré d'oxydation + 3
L' oxyde Co2O3 est obtenu à l'état hydraté par action d'oxydants énergiques sur l'hydroxyde de cobalt (II) ; il est alors noir ou brun foncé. Il joue le rôle d'oxyde acide dans les cobaltites tels que FeCo2O4 ou ZnCo2O4 et le rôle d'oxyde basique dans les sels de cobalt (III) tels que CoCl3, vert sombre, Co2(SO4)3, 18 H2O, vert-bleu et fournissant des aluns de couleur bleue, Co(CH3CO2)3, vert-brun. Ces sels, peu stables, sont des oxydants très énergiques décomposant l'eau dès la température ordinaire avec dégagement d'oxygène.
Il existe en revanche un nombre extrêmement élevé de complexes très stables du cobalt (III) hexacoordiné ayant une structure octaédrique reconnue par A. Werner ; ils sont généralement diamagnétiques, donc à spin faible. Parmi les plus importants, il y a : les sels lutéo contenant le cation [Co(NH3)6]3+, les sels roséo avec le cation [Co(H2O)(NH3)5]3+, les sels purpuréo avec le cation [CoCl(NH3)5]2+ qui font partie des cobalts (III)-ammines ; les cobalt (III)-hexacyanures, les cobalt (III)-hexanitrites tels que K3[Co(NO2)6], précipité jaune très peu soluble dans l'eau, alors que le sel de sodium est soluble.
Il existe des complexes polynucléaires, notamment ceux qui sont obtenus par oxydation et dans lesquels on envisage la présence d'un cobalt (IV).
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean AMIEL : ancien élève de l'École nationale supérieure de physique et de chimie de Paris, agrégé de physique, professeur honoraire de chimie générale à l'université de Paris-VI-Pierre-et-Marie-Curie
Classification
Pour citer cet article
Jean AMIEL. COBALT [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le cobalt est utilisé dans des aciers très spéciaux dont il modifie certains processus structuraux. -
AIMANTS
- Écrit par Roger FONTAINE
- 6 273 mots
- 13 médias
...supérieure au point de Curie de l'alliage. On améliore les propriétés magnétiques des alni en ajoutant certains éléments ; ainsi l'addition de cuivre et de cobalt permet de passer des alliages Fe-Ni-Al aux alnico isotropes à propriétés améliorées. Le point de Curie augmente avec la teneur en cobalt et sa... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 362 mots
- 5 médias
Les superalliages à base nickel sont utilisés entre 600 0C et moins de 1 000 0C.Les superalliages à base cobalt ne deviennent intéressants que si la température de travail est trop élevée pour les bases nickel (en général vers 1 000 0C). Ils ne sont pas aussi résistants mécaniquement... -
CARBONE
- Écrit par Jean AMIEL, Henry BRUSSET
- 8 257 mots
- 11 médias
Vers1940, on constata que les carbonyles métalliques, et celui de cobalt en particulier, étaient des catalyseurs jouant le rôle de transporteurs d'oxyde de carbone sur des molécules organiques au cours des synthèses « oxo » ; de grandes firmes industrielles prirent vers 1950 des brevets et les mirent... - Afficher les 13 références
Voir aussi