CÉSIUM
Propriétés
Les principales constantes physiques sont indiquées au tableau.
Le césium cristallise dans le système cubique centré. C'est de tous les métaux celui qui possède le rayon atomique le plus élevé et la dureté la plus faible. La vapeur de césium est essentiellement monoatomique.
Le césium possède les propriétés chimiques caractéristiques des éléments de la famille des alcalins. Il est extrêmement réactif, se combinant avec les éléments électronégatifs pour donner des composés typiquement ioniques, solubles dans l'eau et qui constituent des électrolytes forts.
Le césium se combine avec l'hydrogène pour donner un hydrure salin CsH, de structure analogue à celle du chlorure de sodium, dans lequel l'hydrogène se trouve sous forme d'ion H-. Peu stable, CsH se décompose avant fusion.
Le césium brûle en présence d'un halogène. En raison de la taille de l'ion Cs+, les variétés usuelles d' halogénures ne possèdent pas la structure NaCl correspondant à la coordination 6 ; elles cristallisent avec une maille cubique centrée, l'ion Cs+ situé au centre se trouvant entouré par huit ions X- (X = Cl, Br, I) situés aux sommets. Ces halogénures forment entre eux ou avec d'autres halogénures métalliques des complexes colorés bien cristallisés et généralement peu solubles (Cs(Cl2I) ou Cs2PtCl6, par exemple).
La réactivité de l'oxygène vis-à-vis des métaux alcalins augmentant avec le numéro atomique, le césium est de tous les métaux celui qui présente la plus grande oxydabilité. Mis en contact avec l'air, le métal s'enflamme instantanément en donnant surtout un peroxyde CsO2 correspondant à l'ion O-2, contrairement au sodium et au lithium dont la combustion conduit à des oxydes correspondant respectivement aux ions O2-2 et O2-. Cette différence de comportement est liée à la diminution du potentiel d'ionisation avec le rayon ionique.
Le système césium-oxygène est complexe ; il comporte, en plus de l'oxyde normal Cs2O, des sous-oxydes et des peroxydes. Tous les oxydes de césium, contrairement aux autres oxydes alcalins, sont fortement colorés, certains sont noirs. L'action de l'eau sur les oxydes conduit à l'hydroxyde CsOH, nommé parfois césine ; c'est une base forte.
Le césium brûle dans la vapeur de soufre en donnant un monosulfure Cs2S et une série de polysulfures Cs2Cn avec n = 2,3,4,5,6. Ces composés de couleur jaune ou rouge, solubles dans l'eau, sont constitués de chaînes d'atomes de soufre terminées par deux atomes métalliques. Les valeurs élevées de n dans le cas du césium – alors que n dans le cas du lithium prend les valeurs 2 et 4 – s'expliquent également par la taille du cation Cs+.
Le césium se dissout très facilement dans l' ammoniac liquide en donnant une solution bleue. La présence d'ions césium et d'électrons solvatés :
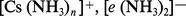
Le césium se combine avec l'acétylène pour donner les deux carbures Cs − C ≡ C − H et Cs − C ≡ C − Cs ; ces composés ioniques incolores sont très réactifs et facilement hydrolysables. Quelques composés organométalliques du césium ont été signalés.
Le césium liquide réagit vivement avec le graphite en donnant une famille de composés lamellaires d'insertion, à caractère métallique, dont le plus riche, de couleur jaune, correspond à la formule structurale C8Cs.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Roger NASLAIN : docteur ès sciences, ingénieur chimiste, professeur à l'université de Bordeaux-I
Classification
Pour citer cet article
Roger NASLAIN. CÉSIUM [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Article mis en ligne le et modifié le 14/03/2009
Médias
Autres références
-
DIAGRAPHIES, géophysique
- Écrit par Oberto SERRA
- 6 081 mots
- 7 médias
...précédente, mais on soumet cette fois les formations à un bombardement continu de rayons gamma d'énergie égale à 662 kiloélectronvolts émis par une source de césium137Cs. Ces rayons gamma perdent de l'énergie par collision avec les électrons (effet Compton). Un détecteur à scintillation situé à une... -
MÉTAUX - Métaux alcalins
- Écrit par Jean PERROTEY
- 3 023 mots
- 5 médias
-
POLLUTION
- Écrit par François RAMADE
- 20 869 mots
- 16 médias
...d'irradier l'organisme qu'ils contaminent pendant une durée prolongée. Tel est par exemple le cas du strontium 90 (période de 28 ans), qui se fixe dans les os car il est chimiquement voisin du calcium, ou ducésium 137 (analogue du potassium), de période de trente-deux ans, qui se fixe dans les muscles. -
SOLS - Dégradation des sols
- Écrit par Mireille DOSSO
- 4 911 mots
- 10 médias
...au développement durable (C.G.D.D.) du ministère de l'Écologie, du Développement durable, des Transports et du Logement, publiées en 2010, le césium 137 présent dans l'environnement a deux origines principales : les retombées des essais atmosphériques d'armes nucléaires effectués entre 1945 et...






